A 2018-ban Nobel-díjat nem kapták orvosnak, a Popular Mechanics folyóiratot
CTLA-4: Hogyan lehet az immunrendszert megölni a rákos sejteket?
A jelöltek első csoportja, a Thomson Reuters néven James Ellison, Geoffrey Blyustoun és Craig Thompson szerepelt. James Allison egész életében a rák elleni küzdelmet szentelte. Tanulmányok, amelyekben részt vett, forradalmasította a rák kezelését. Ő lett az egyik úttörője a természetes immunitásnak a rákos sejtek elleni küzdelemben.
Az immunrendszer sejtjeinek legnagyobb részét, a limfocitákat, a feltárás során végzik. Vannak, akik a belső szervek lakóinak életét vezetik, egy másik rész folyamatosan átkerül a keringési rendszeren. Ahhoz, hogy a cserkészek harcosokká váljanak, vagy fordítva, a T-limfocitáknak kémiai jelre van szükségük. Részben a T-limfociták aktiválódnak, amikor találkoznak egy potenciális ellenfélgel, de a kilencvenes évek elején a tudósok számára nyilvánvalóvá vált, hogy más stimulációs mechanizmusok is fontosak. A limfocitákra vonatkozó további jeleket a membránfehérje-receptorok biztosítják. Egyesek a limfociták ellen harcolnak az ellenanyagokkal szemben, míg mások, éppen ellenkezőleg, deaktiválják, vagy akár elpusztítják. Napjainkig a limfociták három fő protein-deaktiválószere: a PD-1, a CTLA-4 és a TIM-3. A leukociták működését kizáró fehérjék nem kevésbé fontosak, mint a fehérjeaktivátorok: ezek nélkül a szervezet immunrendszere megöli az egészséges sejteket is. Vizsgálatuk a modern immunológia elsődleges frontja az onkológiában.

Allison létre a rák gyógymódját vizsgálatával membránfehérje a CD28 limfociták, amely kiváltja „harcos” módban, és a fehérje CTLA-4, amely kikapcsolja a limfocita, megakadályozza, hogy elpusztítja a sejteket.
Nagy mértékben hozzájárult a tanulmány a funkciók CD28 és CTLA-4 van Jeffrey Bluestone és Craig Thompson: bizonyították, hogy ezek a fehérjék párban dolgoznak, akkor aktiválja, kikapcsolása limfocita (Kutatásai azt feltételezték, hogy ezek a fehérjék felelősek limfocita osztály). Blyuston és Thompson felfedezése meglepte a kollégáit: senki sem várt arra, hogy két homológ fehérje viselkedjen tökéletesen egymástól.
Ellison elképzelése az volt, hogy "kapcsolja ki a kapcsolót" - a CTLA-4 deaktiválására, hogy a limfocitáknak legyen esélyük a rákos daganat leküzdésére. Ellison feltételezését a tudományos közösségben nagy szkepticizmussal fogadták el, de a klinikai vizsgálatok eredményes eredményeket produkáltak: 4 hónap elteltével a CTLA-4-inhibitorokkal kezelt betegek több mint 20% -a túlélett. A kontrollcsoportban senki nem élt túl. Az Ellison, Blyustoun és Thompson tanulmányai alapján kifejlesztett gyógyszerek több ezer életet mentettek meg.
PD-1: Hogyan ne hagyja az immunrendszer pihenését?
A második csoport a biológusok, hogy Thompson Reuters Más Nobel kitüntetettek, szintén részt vesz immunterápia a rák, azonban már használja a PD-1 - receptor, amely kiváltja sejthalál folyamatát programmiruemots.
Mindez a nyolcvanas években kezdődött, amikor a japán biológus, Tasuku Hondze. Munkáit a PD-1 fehérje munkájának tanulmányozására is szánják. A nyolcvanas években Khondze létrehozta a PD-1 szintéziséért felelős géneket, és meghatározta szerepét a szervezetben: kiderült, hogy ez a fehérje felelős az apoptózisért - az önmegsemmisítő sejtek folyamatáért.
Harvard biológus Gordon Freeman (névrokon megfelelője és leghírhedtebb orvos Half Life), amely ugyanazzal a fehérje receptorok A T-limfociták - CTLA-4 és CD28, valamint a szoftver sejthalál mechanizmusok és PD-1. Freeman kísérleteiben az egerek, akiknek limfocitái nagyon kevés PD-1-et termeltek, a korai gyermekkorban számos autoimmun betegségből halt meg. E fontos fehérje hiányában, amely a CTLA-4-hez hasonlóan deaktiválja a limfocitákat, immunitásuk minden szervüket és szöveteiket megöli.
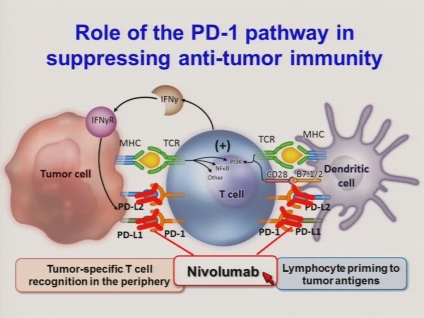
Freeman sikeresen leírta munkája mechanizmusát. A PD lymphocyta felszínén lévő megfelelő PD-L1 ligandumhoz - például a CTLA-4-hez - kötődve a limfociták deaktiválódnak. Ezenkívül a PD-1 kiváltja az apoptózis folyamatát - egy programozható sejthalál. Az egészséges szervezetnek néha meg kell ölnie a saját limfocitáit - például a terhesség alatt, hogy a test nem gyümölcsöt adjon egy idegen testnek, amelyet el kell pusztítani. A mechanizmus az autoimmun betegségekben is megkezdődik, amikor a szervezetnek meg kell ölnie egy túlzottan aktív immunrendszert a túlélés érdekében.
Gordon Freeman és Arlene Sharp azt találták, hogy a daganatos sejtek a PD-L1 / PD-1 komplexet saját célokra használhatják, megtévesztve a szervezetet az immunrendszer kikapcsolására. Majdnem 15 éve olyan gyógyszerek kifejlesztésén ment keresztül, amelyek olyan antitesteken alapulnak, amelyek a PD-1-hez kötődnek, és megakadályozzák, hogy betöltsék funkcióját. A klinikai vizsgálatok különösen jól sikerültek melanóma páciensek esetében: a betegek 40% -ánál hihetetlenül hosszú távú remissziót figyeltek meg. Más típusú rák esetében a gyógyszerek valamivel kisebbek voltak, de még mindig hatékonyak voltak. Számos szempontból a PD-1 gátló készítmények fejlesztésének előrehaladása összefüggésbe hozható Freeman és Sharp nagyvonalú döntésével, hogy megnyitják saját terveiket és szabadalmaikat az egész tudományos közösség számára. Ez számos laboratóriumot érintett a világon az ilyen gyógyszerek kifejlesztésében.
mTOR: Hogyan lehet megállítani az ellenőrizetlen sejtosztódást?
Mindez egy olyan baktérium felfedezésével kezdődött, amelyet a Húsvét-szigeten előállított talajminta okozott, és amely erős gombaölőszert termelt. Az anyagot rapamicinnek nevezték. Amikor azt kipróbálták, hogy emberi gombás megbetegedések kezelésére alkalmazzák, azt találták, hogy a rapamicin képes csökkenteni az immunrendszert a T-limfociták életciklusának szabályozásával. Aktívan alkalmazták az autoimmun reakciók és szervátültetés megakadályozására.
A 90-es évek elején meg lehetett érteni, hogyan működik a rapamicin. Egy genetikai vizsgálat kimutatta, hogy ahhoz, hogy a rapamicin leállhasson, meg kell hallgatni a három gént. Ezeknek a géneknek a transzkripciós termékeit "rapamicin célpontnak" (rapamicin célpontja, TOR) nevezik. Három évvel később elkészült az élesztővel kapcsolatos kutatás, és a tudósok az emlősökben a rapamicin célpontjához fordultak. Kiderült, hogy mTOR fehérje.
Az mTOR munkája a fehérjék foszforilezése, mivel ezeket "sejtes szállítószalaggal" szintetizálják - a riboszómát. Az atomok foszfátcsoportjának hozzáadása az egyes aminosavakhoz (fehérjék "építőkövei"), az mTOR meghatározhatja a fehérje sorsát, aktivitását vagy inaktivitását a sejtben. A legtöbb olyan fehérje, amellyel az mTOR működik, felelős a sejtnövekedés és -osztódás folyamatáért, valamint a celluláris metabolizmus folyamatáért. Ha az mTOR túlságosan aktívvá teszi őket, akkor a sejtek szabályozatlan részleget kezdnek - rákos daganatgá alakulnak. Most a tudósok dolgoznak az előkészületeken - az mTOR gátlókon. A legutóbbi fejlemények ezen a területen arra irányulnak, hogy megakadályozzák a fehérje számára, hogy az ATP molekulából foszfátcsoportot szerezzen, és ezáltal megfosztja azt az alapvető feladatának elvégzésétől.