Nyersanyagok ammónia előállításához
Az ammónia technológiai tulajdonságai.
Az ammónia (NH3) - színtelen gáz, szúrós szagú, és forráspontja -33,4 # 730; a C és olvadáspontja -77,8 # 730; a C ammónia jól oldódik vízben (750 liter egy liter víz), mérsékelten oldódik szerves oldószerekben .
Vízzel reagáltatva az ammónia a következő összetételű hidrátokat képez:
A reakció eredményeként kis mennyiségű vízben oldott ammónia molekulák ionizálódnak:
A disszociáció mértéke 0,004.
A folyékony ammónia feloldja az alkáli- és alkáliföldfémeket, foszfort, ként, jódot és sok más szervetlen és szerves vegyületet.
1300 ° C-os hőmérsékleten az ammónia nitrogéngázt és hidrogént disszociál:
A száraz ammónia robbanásveszélyes keveréket képez levegővel, amelynek robbanási határai a hőmérséklettől függenek.
Az ammónia világszerte több mint 90 millió tonna volt 1980-ban.
Az első ammóniagyártó üzem 1913-ban indult, napi 25 tonna kapacitással.
Az ammónia előállításának nyersanyaga az N2 készítmény nitrogén-hidrogén keveréke (ABC): H2 = 1: 3. A légköri nitrogén forrása gyakorlatilag kimeríthetetlen, ezért az ammónia termelését elsősorban a hidrogén előállítása határozza meg.
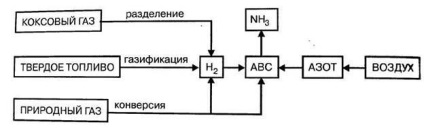
4.3. Ábra. - Az ammónia termelés nyersanyagai.
A cseppfolyósított légkör levegőjének desztillálásával a nitrogén keletkezik.
Az ammónia szintéziséhez hidrogén képződik:
1. a visszatérő kokszológáz elválasztása,
2. A szilárd tüzelőanyag gázosítása,
3. A földgáz (metán vagy gázhomológia) átalakítása,
4. A szénmonoxid átalakítása gőz,
5. Metán repedés
6. Víz elektrolízisével vagy termikus bomlásával
A metán- és a szén-monoxid-átalakítási módszerek, valamint a koksz-gáz elválasztása nagy jelentőséggel bír.
A hidrogén ipari és energetikai célú széles körű felhasználására vonatkozó ígéretes tervek alapján nagy mennyiségű víztermelést tervez - a legolcsóbb alapanyagok, amelyek tartalékai korlátlanok. A vízből származó hidrogén előállítására már létező és fejlett módszerek három csoportra oszthatók:
1. a víz elektrolízise
2. Termokémiai módszerek
3. Kombinált termikus és elektrokémiai módszerek.
Az ELECTROLYSIS a leginkább elsajátított módszer a hidrogén előállítására a vízből, jelenleg kis mennyiségben használják olcsó villamos energia jelenlétében. Az elektrokémiai folyamatok az elektromos energia kémiai energia kölcsönös átalakításán alapulnak, és fordítva. Előnyei elektrokémiai folyamatok - az egyszerűség hardver tervezési, malostadiynost folyamat, nagy tisztaságú a kapott termékek, a nadostizhimaya kémiai módszerek, stb A fő hátránya elektrolízis -. Magas energiafogyasztás, amely képezi a nagy részét a költségek a termékek költsége - 90%. Ezenkívül a vizes oldatok ipari elektrolízisével az energiafelhasználási tényező nem több, mint 50-60%, ami tovább növeli az elektrolízis termékek költségét. A készítmény a hidrogén-víz elektrolízisével használjuk az elektrolit, vizes oldatai savak, lúgok vagy ezek sói, például az elektromos vezetőképesség a tiszta víz elhanyagolható - 18 ° C-on a vezetőképessége víz (2-6) × 10 10 cm × m -1. Leggyakrabban alkalikus elektrolitok, amelyek a legkevésbé agresszívek az elektrolizáló szerkezeti anyagok számára. A hidrogén kialakulása a katódon a reakcióval történik:
Az atomerőmű által termelt villamos energia felhasználásával a víz elektrolízisének teljes hatékonysága nem haladja meg a 20-30% -ot, ami kedvezőtlenül befolyásolja a hidrogén költségét. Az elektrolitikus hidrogén költségének csökkentése a sejtek tervezésének javításával érhető el, csökkentve a költségeket, és ami a legfontosabb, olcsó villamos energia felhasználásával. A fő perspektívát tekintve a hidrogénelektródáknak az atomerőművek "sikertelen" energiájára való bejutásának lehetőségét tekintjük, azaz a villamos energia használata olyan időszakokban, amikor az állomások alulterheltek, például éjszaka.
A hidrogéntermelés termokémiai módszere a víz bomlása alapján, a hélium-hűtést végző atomreaktorokból származó hőenergia bomlásán alapul, a reaktor kilépőhelyén a gázhűtő hőtől függően. A reakció vízzel való közvetlen bomlása
ez nem megvalósítható, mivel ehhez szükséges magas hőmérsékleten (kb. 1000 ° C) a reakcióegyenlet állandó elhanyagolható (10 -6). Folyamat végrehajtásának lehetséges helyettesítésével közvetlen reakciójával víz bomlás termokémiai álló ciklus több szakaszból, amelyek mindegyike egyensúlyi állandó értékek elfogadhatók a gyakorlatban. Kidolgozott és javasolt számos termokémiai ciklusban a víz bontása hőmérsékleten rendelkezésre szempontjából segítségével a hőt a hűtő gázok atomreaktorok. A legtöbb közbenső nagy affinitást mutatnak a hidrogénatom vagy az oxigén javasolt ciklusok - jelentése halogénatom, a IV csoport elemek (kén), csoport II fémek (Mg, Ca. Ba), és az átmeneti elemek változó oxidációs állapotban (V, Fe). Az alábbiakban egy példát mutatunk be olyan reakciók termokémiai ciklusára, amelyek a víz H2-re és O2-ba bomlanak:
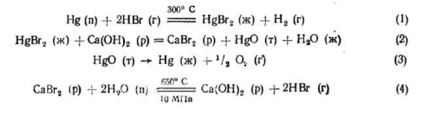
A vízbontás teljes termokémiai ciklusa zárt ciklus, mivel az összes kiindulási reagens elválik a reakciótermékektől és visszatér a ciklusba, kivéve a hidrogén és oxigén képződéséhez felhasznált vizet. A maximális reakcióhőmérséklet nem haladja meg a 700 ° C-ot, és az atomreaktor kimenetén hűtőfolyadékkal 800-900 ° C-on
Jelenleg a javasolt termokémiai ciklusok egyikét még nem hajtották végre az iparban, és a ciklusok hatékonyságának értékét, valamint a hidrogén megszerzésének költségeinek számítását ezzel a módszerrel még nem határozták meg.
A hidrogén előállításának kombinált módja a folyamat termo- és elektrokémiai szakaszainak egyesítése. Várható előnyök állnak a kombinált módszer, hogy lehet használni érdemei minden a fenti módszerek: elektrokémiai jól fejlett, egy egyszerű hardver tervezése és termokémiai gazdaságosabb, de kevés elsajátította, és tartalmazza azokat a lépéseket, amelyeket nehéz ipari alkalmazása.
Példa erre a kénsav kombinált ciklus hidrogén és oxigén előállítására a vízből. Ez egy kétlépcsős folyamat, amely 2 lépést tartalmaz
1. Termokémiai - endoterm reakció, 900 ° C-on
2. alacsony hőmérsékletű elektrokémiai folyamat:
Ez utóbbi reakció csak elektrolízissel valósítható meg, mivel az egyensúlyi állandó és az elméleti hidrogénkibocsátás rendkívül kicsi. Az egyesített üzem energiaforrása atomgáz-reaktor lehet, amely elektrokémiai úton szolgáltatja a hővel eltávolított termokémiai fázist és a villamos energiát. A kombinált növény becsült költségei kisebbek, mint a víz közvetlen elektrolíziséhez. A folyamat általános hatékonysága 35 - 37%. A szakértők szerint a termokémiai és az elektrokémiai fázisok kombinációja a legígéretesebb irány a hidrogén nagy mennyiségű vizes termelésétől.
Az ammónia szintéziséhez szükséges hidrogén megszerzésének fő módszere a metán katalitikus átalakítása. Ennek a módszernek a nyersanyaga a természetes és a hozzá kapcsolódó gáz. amely legfeljebb 90-98% metánt tartalmaz.