Az enzimek aktivációs energiájának hatásmechanizmusa
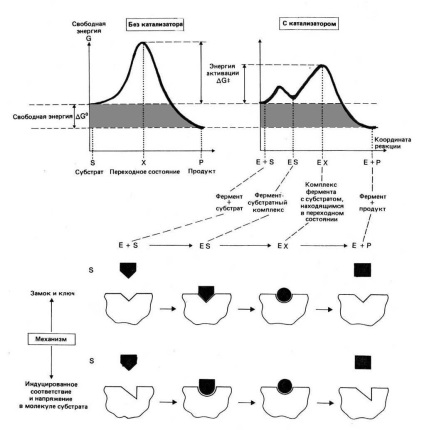
Annak érdekében, hogy a szubsztrátumok reakcióba lépjenek, energiára van szükség, ezt aktivációs energiának (ΔG ‡) nevezik. Minél magasabb a szükséges aktiválási energia, annál alacsonyabb a reakciósebesség egy adott hőmérsékleten. A katalizátorokként működő enzimek csökkentik a reakció előfordulásához szükséges aktiválási energiát. Ezek növelik az általános reakciósebességet anélkül, hogy jelentős mértékben megváltoznának a reakció hőmérséklete.
A szubsztrátumhoz kötődő enzim rövid élettartamú enzim-szubsztrát komplexet (E-S-komplex) képez. Egy ilyen komplexumban a reakció előfordulási esélye jelentősen megnő. A reakció befejeződése után az E-S komplex bomlik egy termékbe (vagy termékekbe) és egy enzimbe. Az enzim nem változott a reakció: a végén a reakció ez ugyanaz marad, mint korábban volt, és ma már képes kölcsönhatásba lépni az új szubsztrát molekula.
Enzim + Alapfelület → E-S-komplex → Enzim / termék (ek)
Módszerek az enzimek reakciósebességének növelésére
Az aktivált komplex stabilizálásával csökkentse az átmeneti állapot szabad energiáját.
A szubsztrátum energiájának növekedése, amikor az enzimhez kötődik, amikor az E-S komplex képződik. Ennek eredményeként csökken az E-S komplex szabad energiáinak és az átmeneti állapot közötti különbség.
Az aktív központ mikrokörnyezetének támogatása a vízi környezetétől eltérő állapotban. Gyakran oldalláncai aminosavak található az aktív hely, a képesség, hogy megszerezzék elektromos töltés képest megváltozott az esetben, ha ezek a áramkörök merítjük a vizes közegben. Ennek eredményeképpen az oldalláncok "fokozott reaktivitást" eredményezhetnek.
A reakcióképes atomok elrendezése a megfelelő orientációban és a kívánt távolságban egymástól, annak érdekében, hogy biztosítsák a reakció optimális menetét. Az atomok hiánya az enzim hiányában nagyon ritkán kémiai reakcióhoz vezet, mivel ebben az esetben az atomok nagyon ritkán fordulnak elő a helyes orientációban.
Aktív központ
Molekulák legtöbb enzim sokszor nagyobb, mint a molekulák a szubsztrátok, mely aktiválja az enzimet, és a kapcsolatot a szubsztrátum az E-S-komplex belép csak egy kis részét az enzim-molekula - általában 3 és 12 aminosavból áll. Bár ezek a szermaradékok térben egymáshoz közel helyezkednek el, gyakran különböznek egymástól a lineáris fehérjeszekvenciában.
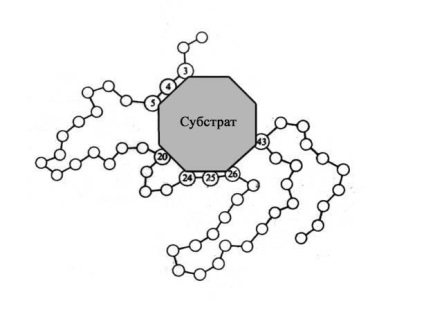
Ábra. Az E-S-komplex (az aljzat az enzimhez az utóbbi aktív centrumában van kapcsolva) vázlatos ábrázolása.
Az enzimmolekula ezen részét aktív központnak nevezik. Itt van az aljzat vagy szubsztrátok kötődnek.
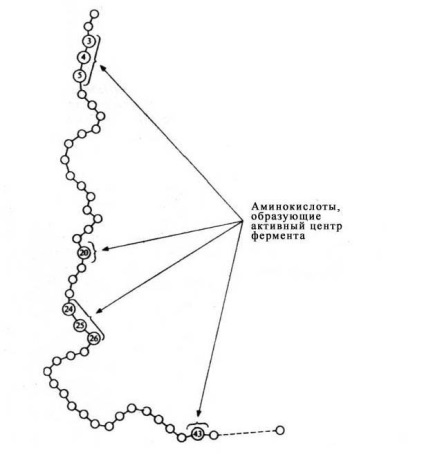
Ábra. 12 Az aminosavmaradékok elhelyezkedése, amelyek az enzim aktív központját képezik az enzim fehérje primer szerkezetében).
A szerepe más aminosavak, alkotó a nagy részét az enzim az, hogy biztosítsák a megfelelő molekula globuláris formában, amely alapvető fontosságú, hogy az aktív hely az enzim képes működni a leghatékonyabban.
Jellemzően, a formáció a E-S-komplex nélkül fordul a kovalens kötések képződését, de a rovására a gyengébb, de jobban meghatározott típusú kölcsönhatások, mint a hidrogén kötések, sóhidak, hidrofób erő és a sűrű atomok.