Víz oldószerként
A biokémia alapjai. Fizikai kémia
Víz oldószerként
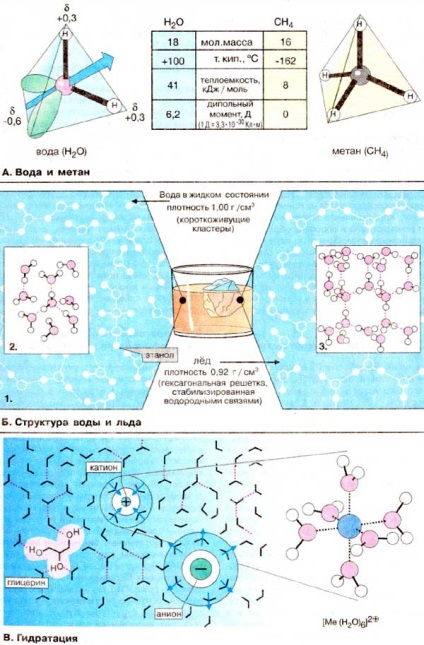
A víz H2O egyedülálló tulajdonságai a metánhoz (CH4) viszonyítva nyilvánvalóak. Mindkét molekula tömege és mérete azonos. Mindazonáltal a víz forráspontja 250 ° C-kal magasabb, mint a metán forráspontja. Ennek eredményeképpen a Föld felszínén lévő víz folyékony állapotban van, és a metán gázállapotú. A víz magas forráspontja a párolgás magas hőteljesítményének a következménye, amely viszont az elektronsűrűség egyenetlen eloszlásának köszönhető a vízmolekulában. A vízmolekula tetraéder formájában van, amelynek közepén egy oxigénatom található. A tetraéder két csúcsait az oxigénatom szabad elektron párjai (zöld szín) foglalja el, míg a fennmaradó kettőt hidrogénatomok foglalják el. Ezért a H-O-H kötések szögben vannak elrendezve. Ezenkívül az oxigénatom magas elektronegativitása miatt az O-H kötés poláris (lásd a 14. oldalt). A hidrogénatomok részleges pozitív töltése körülbelül +0,4, és az oxigénatom részleges negatív töltés körülbelül -0,6, vagyis a vízmolekula elektromos dipólus. Ezért minden vízmolekula, mint egy kis mágnes, még további négy molekulát vonz a hidrogénhidak (B) kialakulása miatt (lásd a 14. oldalt). A víz elpárolgása esetén e számos hidrogénkötés megsemmisülése nagy energiafelhasználást igényel. A metánmolekulák nem polárisak, nem dipolek, és viszonylag gyenge kölcsönhatásban vannak egymással. Ennek eredményeként a folyékony metán nagyon alacsony hőmérsékleten párolog.
B. A víz és a jég szerkezete
A vízmolekulák bipoláris szerkezete kedvez a hidrogénkötések kialakulásának (lásd 14. oldal). Mindegyik molekula mind a donor, mind a hidrogén-akceptor tulajdonságait mutatja. Ezért folyékony állapotban lévő vízben sok molekulát hidrogén "hidak" (kötések) kapcsolnak össze (1). és az így létrejövő munkatársak dinamikus egyensúlyban vannak. Gyakran kialakult tetraéderes szerkezetek, az úgynevezett "klaszterek" a víz (2). A hőmérséklet csökkenésével a klaszterek frakciója a kristályosodás kezdetéig emelkedik. Normál atmoszferikus nyomáson a víz 0 ° C-on kristályosodik, miközben a vízmolekulák nagy részét a hexagonális rácsba ágyazzák (3). Mivel szilárd állapotban a molekulák közötti távolság átlagosan nagyobb, mint folyadékban, a jég sűrűsége kisebb, mint a víz sűrűsége. Ez a víz tulajdonsága nagyon fontos ökológiai értelemben, ha csak azért, mert télen jégréteg alakul ki a tározók felszínén, és csak ritkán lefagy az aljára.
A legtöbb folyadéktól eltérően a víz ideális oldószer az anyagok disszociációjához. Egy ion elektromos mezőjében a vízmolekulák rendszeres szerkezetet alkotnak az ion töltöttségének megfelelően. Ez a hidratált héj védi az ionot az ellenkező töltésű ionoktól. A víz nagy permittivitási állandóval rendelkezik (78), azaz. a vízben két ellentétes töltésű ionok elektrosztatikus attrakciója körülbelül 80-szoros (1/78). A belső szférában közvetlenül az ion közelében lévő vízmolekulák gyakorlatilag immobilizálva vannak (kötve ezzel az ionnal) és a központi ionokkal együtt mozognak. Vízben nagyon oldódik, és számos hidroxilcsoporttal, például glicerinnel (a bal oldali ábrán) vagy cukrokkal semleges vegyületek, mivel képesek hidrogénkötéseket kialakítani az oldószer molekuláival.