Jelentés a munkáról
- a kísérleti rész elméleti igazolása,
- A kísérleti eljárás, beleértve a telepítési rendszert,
- 3.2. Táblázat megfigyelések,
- grafikonos idő függvények, milliméteres papírra építve,
- a kémiai reakció hőjének kiszámítása,
- a mérések relatív és abszolút hibájának kiszámítása.
A relatív mérési hiba nem haladhatja meg az 5% -ot.
Lab 9
Termometriás titrálás
E munka célja egy anyag koncentrációjának meghatározása a kémiai reakciók során felszabaduló hő felhasználásával.
Eszközök és reagensek: egy tesztcső, egy büretta, egy Beckmann hőmérő.
Elméleti igazolás
Az A anyag koncentrációjának meghatározására termometriás titrálást lehet alkalmazni, amely a felszabadított (vagy felszívódott) hő felhasználásán alapul. Ehhez válasszuk ki a B anyagot (titrálószer), amely az A anyaggal a végéig reakcióba lép, majd a titrálást fokozatosan hozzáadjuk a titrált oldathoz. A titrálószer hozzáadása során az A és B anyagok kölcsönhatása felszabadítja vagy elnyeli a hőt, és a reakcióelegy hőmérséklete addig változik, amíg az A anyag teljesen nem reagál. Az A és B sztöchiometrikus arány elérése után a titráló további adagolása nem változtatja meg a reakcióelegy hőmérsékletét, és állandó marad, vagy egyenletesen változik a környező közeg hőcseréi miatt. A reakcióelegy hőmérsékletének a hozzáadott B oldat mennyiségének változásától függő görbe alapján egy inflexiós pont jelenik meg, amely lehetővé teszi a B anyag sztöchiometrikus mennyiségének meghatározását.
Termometriás titrálást alkalmaznak, ha más titrálási módszerek nem alkalmazhatók. A titráló reagens sikeres kiválasztásával az eljárás alkalmazható színezett, viszkózus anyagok és gyantás vagy szilárd szennyeződést tartalmazó rendszerek titrálására. A következő típusú reakciókhoz termometriás titrálás használható:
1) savak és bázisok kölcsönhatása:
Koncentráció titráljuk nem lehet kevesebb, mint 0,05 ... 0,5 N (alacsony koncentrációban, kis változás a hőmérséklet), és nem több, mint 1 N, hiszen keverési tömény oldatok savak és lúgok mellett a semlegesítési hő kíséri hőfelszabadulás hígítás;
2) olyan reakciók, amelyekben az egyik végtermék gyakorlatilag oldhatatlan csapadék:
;
.
Minél alacsonyabb a csapadék oldékonysága, annál nagyobb a titrálási eredmények pontossága. A fenti hidroxidok oldékonysága:
;.
Ezeknek a csapadékoknak a jelentéktelen oldhatósága lehetővé teszi a Li + és Na + ionok koncentrációjának megfelelő pontossággal ( 1%) történő meghatározását 0,05 ... 0,5 n oldatban;
3) olyan reakciók, amelyekben az egyik termék oldható stabil komplex vegyület:
A komplex vegyület stabilitását az instabilitási állandó határozza meg:
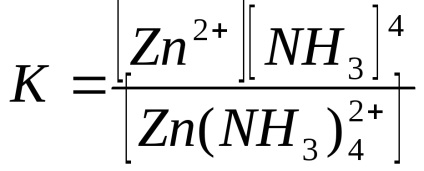
Ebben a tanulmányban a sósav koncentrációját a semlegesítési reakció termikus hatásától kell meghatározni.
A titrált oldatból 20 ml-t öntse be egy állványra rögzített, üvegbe zárt csőbe, majd az üvegkeverőbe és a Beckmann hőmérőbe merítse az oldatot. 2 ... 3 percen belül vegye figyelembe a hőmérséklet-változást. A hőmérsékletváltozás mértéke nem haladhatja meg a 0,02 fokot. A hagyományos hőmérő segítségével hasonlítsa össze a titrált oldat és a titráló hőmérsékletét. Ha a hőmérséklet-különbség nem haladja meg a 0,1 ° -ot, öntsük a titrát egy ugyanabba az állványra rögzített bürettára, mint a kémcsövet. A büretta végét le kell ereszteni a csőbe oly módon, hogy a titráló ne essen a hőmérőre, és folyamatosan öntse a titrált oldatba. Titrálja a keveréket mindvégig a keverés közben. A Beckmann hőmérő leolvasását fel kell jegyezni minden egyes titráló térfogat után. A kapott adatok alapján ábrázoljon egy grafikont a titráló hőmérséklet-térfogati koordinátáiban (6.
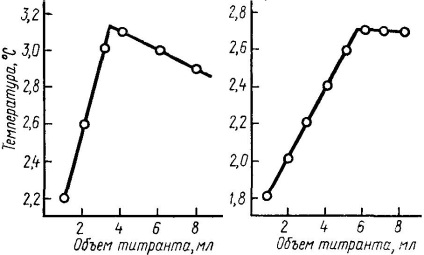
Ábra. 3.6. A hőmérés görbéi.
A lényeg egyenértékűségének titrálással egy első előzetes vizsgálat megállapítása a menetrend alapján és az adathalmaz feltételeit három pontos kísérletek alapján az alábbi feltételezések: az ekvivalencia titrálási pontot kell elhelyezkednie a tartomány 3 ... 8 ml, a titrálószer oszlop magassága változik byuretkek és térfogata titráljuk csökkentse öntés sebessége és így további törje meg a görbe, ami megnehezíti a meghatározása a egyenértékpont. Ha a ekvivalenciapont fekszik a tartomány 3 ... 8 ml, és a koncentrációt a titrálható mérőoldat változatlan marad; a 0 ... 3 ml közötti tartományban csökkenteni kell a titráló koncentrációt; 8 ml vagy ennél hosszabb ideig a titrált oldat koncentrációját csökkenteni kell. A végső titráláskor rögzítse a Beckmann hőmérő leolvasását 0,5 ml oldat hozzáadásával. Az egyenértékűségi pont meghatározására szolgáló egyedi kísérletek eredményei közötti eltérés nem haladhatja meg a 0,2 ml-t.