Kémiai megfelelő, tartalom platform
Kémiai megfelelő.
1. Az ismétlés elméleti szakasza.
Abszolút és relatív atomtömeg. Abszolút és relatív molekulatömeg. Mol. Moláris tömeg. Az anyag minőségi és mennyiségi összetétele.
Az anyag tömegének megőrzésének törvénye. A kompozíció állandósultsága. Az egyszerű volumenű kapcsolatok törvénye. Avogadro törvénye és következményei. A gáznemű anyagok moláris mennyisége. A gázok relatív sűrűsége.
A gáz halmazállapotú anyagok molekulatömegének meghatározása relatív sűrűségben. Az egyszerű és összetett anyagok kémiai megfelelője. Egyenértékűségi tényező. Az ekvivalens móltömege. Az ekvivalens moláris térfogata. Az ekvivalensek törvénye.
2. Kérdések és gyakorlatok.
1. Határozzuk meg a következő anyagok relatív molekuláris és móltömegét: CuSO4, CO2, K2Cr2O7.
2. Az anyag mennyisége mol-ban 320 g vas-oxid (III) mennyiségben van jelen?
3. Számítsa ki a mangán tömegarányának értékét mangán-oxidban (IV).
4. Milyen tömegű lesz normál körülmények között 60 L oxigén?
5. A gáz hidrogén feletti relatív sűrűsége 35,5. Adjuk:
a) a gáz móltömege;
b) a levegő relatív sűrűsége,
c) a gáz I l tömege.
6. Keresse meg a következő anyagok ekvivalens és moláris ekvivalens tömegét: CuCl2, H3PO4, Ca (OH) 2
7. Mi az egyenértékű, ekvivalens móltömeg és moláris ekvivalens térfogata az alábbi elemek esetében:
a) oxigén b) hidrogén c) klór?
8. 66,5 g tömegű alkálifém vízzel való kölcsönhatása során a hidrogént 5,6 liter hidrogénnel (kb. Milyen fém van?
3. A kísérleti rész.
A magnézium ekvivalens móltömegének meghatározása.
a) Tapasztalat előkészítése.
A kísérlethez az eszközt a 2. ábra szerint gyűjtjük össze. 1, ahol: A - kerek lapos fenekű lombikba, 250 ml B - kerek lapos fenekű lombikba, 500 ml B - es főzőpohárba 300 ml, a T - szifon üveg és gumi csövek, D - a bilincset a szifon, E - összekötő cső.
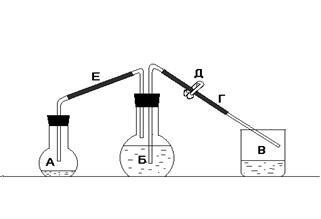
Ábra. 1 A fém egyenértékének meghatározására szolgáló szerelési séma
Egy mérőhengerbe vagy kémiai főzőpohárba 50 ml hígított oldat mért mennyiség kénsavat, körülbelül 20-25 ml és öntjük lombikba A. Ha a sav behatol a lombik nyakát, akkor letöröljük a belső oldalán szárazra levél szűrőpapírra.
Egy nagy lombikban töltse fel a csapvizet a vállakkal, helyezzen be egy dugót a kivezető csövekbe a nyakba, töltse fel az egész szifont vízzel. Ehhez tartsa vízszintesen a mosogató feletti lombikot, és nyissa fel a D szorítópofát. Ha a víz, a szifonból a levegő átszivattyúzása folytonos árammal folyik le, akkor a bilincs le van zárva. Ebben az esetben megfigyelhető, hogy a bilincs meg van tartva, vagyis a szifoncsőből származó víz nem önthető ki.
A mérőhengert 50 cm3 csapvízzel pontosan megmérjük (a meniszk alján) és egy B főzőpohárba öntjük. Ezt az eljárást a berendezés stabilitásának biztosítására végezzük a kísérlet során. A G szifon üvegcsőjének vége egy B főzőpohár vízébe merül.
A 100 mg (0,1 g) súlyú magnézium 0,00 g 0,00 g-nál vagy a laboratóriumi asszisztens ismert tömegének magnéziummintáján lévő nyomelempapírra vagy szcencil-ekre mérve.
b) A kísérlet végrehajtása
Az A lombikot savval vízszintes helyzetbe alakítjuk, amint azt az 1. ábra mutatja. 2.
Ábra. 2 A magnéziummintát lombikba helyezzük savval
Egy darab papírral óvatosan öntjük a magnéziummintát az izzó nyakának belső felületére. Ugyanakkor győződjön meg róla, hogy a fém nem érkezik meg korábban a savban.
A lombik nyakán ugyanolyan óvatossággal helyezzen be egy gázdugattyús csővel ellátott dugót. A parafát fokozatosan kell behelyezni a torokba, enyhén elfordítva.
Az A-lombikot az asztalra függőleges helyzetben helyezzük el, egyszerre nyissa fel a D bilincset és hagyja nyitva.
Magnézium, alá a lombik nyakát egy a sav reagál, és kiszorítja a hidrogén, amely belép a gőz cső E lombikban B. prések a víz és kiszorítja főzőpohárba B. Milyen mennyiségű hidrogén szabadul egy lombikban A. azonos mennyiségű vizet a B lombikból a főzőpohárba B.
Ha a magnézium teljes mértékben reagált a savval (vizsgálja meg a belső falakat és az A izzó nyakát - ne csatlakoztasson semmilyen magnéziumot), ki kell egyenlítenie a készülék belsejében lévő nyomást légköri nyomáson. Ehhez a B főzőpoharat a B. lombikba helyezzük. Emeljük fel úgy, hogy a főzőpohárban és a lombikban levő víz ugyanolyan szinten legyen, és csukja be a D bilincset.
Vegye ki a G szifon kifolyócsövét az üvegből és mérje meg az üvegben lévő teljes vízmennyiséget mérőhengerrel. Az így kapott vízmennyiségből az előzetesen hozzáadott 50 ml-t kivonjuk, és így a térhálósított térfogat térfogatát szobahőmérsékleten találjuk meg.
A magnézium ekvivalens móltömegének értékét a kapott hidrogén térfogatértékből számoljuk ki (lásd a számítási részt).
c) Becsült rész
Az ekvivalens (ekvivalens tömeg) moláris tömegének kiszámításához a kísérlet körülményei között mért hidrogén térfogatot a normál körülmények között (00C és 760 Hgmm) kell csökkenteni az alábbi képlettel:
V0 a gáz térfogata normál körülmények között, ml;
Vex n. - a hidrogén térfogata szobahőmérsékleten, kísérletileg, ml;
t- szobahőmérséklet, С;
h- telített vízgőz nyomása a megfelelő kísérleti hőmérsékleten, mm. Hg. Art. Ez az érték a táblázatban található. 1.
A telített vízgőz nyomás különböző hőmérsékleteken.
A vízgőz parciális nyomására vonatkozó korrekciót az egyenletbe vezettük be, azzal a feltétellel, hogy a gázot a víz felett a lombikban összegyűjtjük, és ezért a rendszerben a teljes nyomás a hidrogén és a vízgőz részleges nyomásának összege.
Az ekvivalensek törvénye alapján, amelyek szerint a reagáló anyagok tömege (térfogata) arányos az egyenértékű tömegükkel (térfogatok), használja a relációt:
m (Mg) a kísérlethez vett magnézium tömege;
V0 (H2) - a kibocsátott hidrogén térfogata, normál körülmények között redukálva, ml;
M (1/2 Mg) a magnézium, g / mol ekvivalensének móltömege
Veqv (H) a hidrogén ekvivalens (11200 ml / mol) moláris térfogata.
Keresse meg a kísérletben megengedett relatív hibát azáltal, hogy az ekvivalens elméleti móltömegét 100% -kal veszi (az elem ekvivalens móltömege megegyezik az elem móltömegének és a vegyértékének arányával).
A tapasztalatot és annak eredményeit a laboratóriumi folyóiratban a következő sorrendben kell formalizálni:
· Az aktív fém ekvivalensének moláris tömegének kísérleti meghatározásának lényege,
· A kísérlet során kapott adatok,
· A teljes becsült rész.