V-egy csoport
A nitrogén olyan oxidok sorozatát képezi, amelyek formálisan megfelelnek az összes oxidációs foknak +1 és +5 között: N2O, NO, N2O3. NO2. N2O5. de csak kettő - a nitrogén-oxid (II) és a nitrogén-oxid (IV) - és nem csak a normális körülmények között stabil, de aktívan részt vesz a természetes és ipari nitrogén ciklusban.
1.2.1 Néhány nitrogénvegyület és tulajdonságaik
Nitrogén-oxidok
N2 + 1 O - nitrogén-oxid (I), dinitrogén-oxid, "szórakoztató" gáz, nem só-oxid. Az N2O-ot az ammónium-nitrát bomlásával nyerik:
A N2 O gyengeséges illatú és édes ízű. Oxigén, víz, savak és lúgok oldata nem reagál. 500 ° C feletti hőmérsékleten elemekké bomlik, vagyis eléggé stabil.
Szerkezet: oxigén 2 párosított elektron, nitrogén 3 - kettős kötést és egy páratlan elektron maradt. Feltételezhető, hogy a NO molekulák párosítanak és dimerikus ONNO molekulát képeznek. A molekula szerkezete: lineáris molekula O = N = N, amelyben az N központi atom négyértékű. Ez képezi két kettős kötést: az egyik - az oxigénatommal a tipikus rendszer létrehozására kovalens kötés (két nitrogénatomot elektron, két oxigénatomot elektron), és a másik - a nitrogénatommal (amely két a három párosítatlan elektront pár és alkotó ezáltal egy üres orbitális) egy a kötések kovalens, a második donor-akceptor (1. ábra). Berendezés, amellyel a nitrogén-oxid (I) áll támaszok, kémcsövek, csövek, amelynek gázkivezető csövet, a penész henger és szellemében lámpa (ábra. 2). Az NH4 NO3-ot a csőbe helyezzük. zárja le a csatlakozót egy gáz kimeneti csővel és melegítse. A gázt vízzel töltött hengerben gyűjtjük össze.
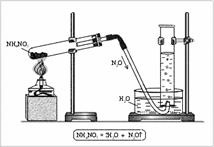

Ábra. 2. A nitrogén-monoxid (I) megszerzése a laboratóriumban
A N2O-oxid bomlik hevítésre:
N2O-oxid reagál hidrogénnel:
N + 2 O - nitrogén-oxid (II). nem sót formáló oxid. A NO-t úgy kapjuk meg, hogy a réz reakcióját egy savas HNO3-val (decib.) (3.
A kristályrács molekuláris; a molekula világos, gyengén poláris (az oxigén elektronegativitása valamivel magasabb, mint a nitrogéné). Feltételezhető, hogy az olvadáspont és a forráspontja alacsony, de magasabb, mint a nitrogén, azaz. K. A polaritás a molekulák lehetővé teszi, hogy csatlakoztassa a elektrosztatikus vonzóerő, hogy egyszerűen intermolekuláris erők. A dimer képződése szintén elősegíti a forráspont növekedését. A molekula szerkezete alacsony vízoldékonyságot mutat. A nitrogén-oxid (II) nem rendelkezik sem színnel, sem szaggal.
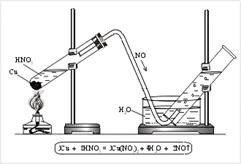

Ábra. 3. Nitrogén-oxid (II) megszerzése a laboratóriumban
A (II) nitrogén-oxid előállításához kis csöveket helyezünk a csőbe, és a hígított salétromsavat öntjük. A csövet egy gázcsővel ellátott parafa dugóval zárják, és állványra erősítik. A gázkivezető cső vége vízbe és továbbhalad a hűtőbe (3. ábra). Melegítés esetén a NO szabadul fel. A NO-t könnyen oxidálják a levegő oxigénjei, azaz redukálószerként működnek:
A kén-dioxiddal való reakcióban NO-oxidáló anyag:
N + 22O3 - nitrogén-monoxid (III). dinitrogén-anhidrid (megfelel a nitrous savas HNO2 és a nitrit sóknak); savas oxid, melyet a savas oxidok tulajdonságai jellemeznek. Az N2O3 oxidot a következő reakcióval állítjuk elő:
Tekintsük a nitrogén-elektronokat a NO molekulában. Ez a páratlan elektron, egy szabad elektronpár és még két elektron az oxigénnel kapcsolatban - csak öt. És az oxigénatom, "kijön a linken", hat elektron négy forgásirányban. Ha kettőben vannak elhelyezve, akkor egy orbitális marad. Ezt a nitrogénatom elektronpárja foglalja el (4., 5. ábra).
Ábra. 4. Az NO2 molekula elektronszerkezetének rendszere (első változat). (A pontok az O atomok elektronjait jelölik, a keresztek az N atom elektronjait reprezentálják)
Ábra. 5. Az NO2 molekula elektronszerkezetének rendszere (második opció). (A csillag a gerjesztett O atomot jelöli, a nyíl jelzi a donor-akceptor kötést.
Miután egy pár elektront az S-pályákon találtak "csatlakozásra", egyszerűen hibridizálni kell. Felmerül a kérdés: milyen típusú hibridizációt használ az atom? Válasz: a nitrogén három elektrontengelye a sp2-hibridizáció állapotában van. Az NO2 molekula szögletes, 134 ° -os szöggel (120 ° -nál nagyobb szög, mivel 1 elektron taszítja a kommunikációs elektronokat, amelyek gyengébbek, mint egy pár elektron) (6, 7).
A kristályrács azonban molekuláris, mivel maga a molekula nehezebb a NO-nál, és a dimerizációs hajlandóság jóval magasabb, ezért meg kell olvadnia és forrni kell jelentősen magasabb hőmérsékleten. A forráspont 21 ° C, így normál körülmények között - 20 ° C és 760 Hgmm. Art. - A nitrogén-oxid (IV) folyékony.
A nitrogén-oxid (IV) vízben oldódik, egyidejűleg reagál, és ugyanakkor két sav keletkezik.
Ábra. 7. Az NO2 molekula egy "oldalsó" nézet a donor-akceptor kötés oldaláról. (A második oxigénatom nem látható a nitrogén atomja körül. Az árnyékolt körök az atomok felé irányított hibridizált orbitálisok.)
A nitrogén-oxid (IV) jellemző éles szaga és rozsda-barna színű, amelynek színei a koncentrációtól függően különböznek egymástól. Ez a szín a nitrogén-oxidok légkörbe történő emisszióját "róka faroknak" nevezi [4].
3) Hűtés közben dimerizáció:
-11 ° C hőmérsékleten az egyensúly teljesen eltolódik jobbra és +140 ° C-ra - teljesen balra.
1.2.1.2. Salétromsav
A nitrogén-hidroxidok közül a legnagyobb több tonnatartalmú salétromsavat tekintjük.
A salétromsav molekula poláris (az oxigén és a hidrogén különböző elektronegativitása miatt, mivel a nitrogén rejtve van a molekulán belül) és aszimmetrikus. Mindhárom szög a nitrogén és az oxigén kötése között különbözik. A nitrogén oxidáció formális szintje magasabb (+5). De ebben az esetben csak 4 kötés van a nitrogénatom és más atomok között - a nitrogén vegyérték 4.
Egy molekula szerkezetét könnyebben megérthetjük, ha figyelembe vesszük a megszerzés folyamatát. Salétromsav által termelt reakciót a nitrogén-oxid (IV) vízzel (az oxigén jelenlétében): két molekula NO2 egyidejűleg „támadás” a vízmolekula azok párosítatlan elektronnal, keletkező kötésnek a hidrogén és oxigén van törve, nem a szokásos (elektronpár a oxigén és a „csupasz proton "), És egy molekula NO2 hidrogént kap az elektronjával, a másik - az OH-gyököt (8. ábra). Alakult két savak: mindkét erős savak, mind gyorsan ad a proton legközelebbi vízmolekulákat, és össze ionok formájában NO2 - és NO3 -. A NO2 ion instabil, két HNO2 molekula vízbe, NO2-ba és NO-ba bomlik. A NOx oxid oxigénnel reagál, nitrogéngázra átszámítva. és így tovább, amíg csak salétromsavat kapsz.
Ábra. 8. A salétromsav és a salétromsav molekulák képződésének rendszere. (A fekete golyó egy N atom, a nagy fehér golyók O atomok, a kis fehér golyók H atomok)
Formálisan, úgy tűnik, hogy egy oxigénatomot kapcsolódik a nitrogénatomhoz egy kettős kötés, és a másik - a hagyományos egyszeres kötés (ez az oxigénatom is kapcsolódik egy hidrogénatom). A harmadik oxigénatomon a HNO3 nitrogénjét a donor-akceptor kötés köti össze, a donor nitrogénatomja. Ebben az esetben a nitrogénatom hibridizációjának sp2-nek kell lennie, mivel kettős kötés van jelen, ami meghatározza a szerkezetet - egy lapos háromszöget. Valójában úgy tűnik, hogy valóban fragmenst a nitrogénatomot és három oxigénatomból - egy lapos háromszög, csak egy molekula salétromsav háromszög helytelen - ONO mindhárom szöge különböző, következésképpen, különböző oldalán a háromszög. Amikor a molekula disszociálódik, a háromszög szabályos, egyenlő oldalú lesz. Ezért az oxigénatomok egyenértékűvé válnak. Minden link megegyezik.
A salétromsav fizikai tulajdonságai
Az ionizált vegyületet, még ha részlegesen is, nehéz gázgá alakítani. Ezért a forráspontnak elég nagynak kell lennie, de ilyen kis molekulatömeg mellett az olvadáspontnak nem szabad magasnak lennie. Következésképpen az aggregált állapot 20 ° C-on folyékony. Ami az oldhatóságot illeti, mint sok más poláris folyadék, a salétromsav könnyen keverhető vízzel bármilyen arányban. A tiszta salétromsav színtelen és szagtalan. Azonban, mivel a bontás oxigén és nitrogén-oxid (IV), amelyben feloldottuk, és azt lehet mondani, hogy a hagyományos koncentrált salétromsavval egy sárga-barna színű, és jellegzetes, átható szaggal NO2. Lássuk, hogyan befolyásolja a salétromsav molekula szerkezete a kémiai tulajdonságait.
HNO3 - erős oxidálószer
Ha a HNO3 kölcsönhatásba lép a fémekkel (M), a hidrogén nem szabadul fel:
M + HNO3-só + víz + gáz.
HNO3 (konc.) HCl-oldattal (konc.) 1: 3 térfogatarányban (1V HNO3 + 3V HCI) "királyi vodka" -nak nevezzük.
A salétromsav nem reagál más savakkal a csere- vagy vegyes reakciók típusával. Ugyanakkor teljesen képes reagálni erős oxidálószerként. A koncentrált salétromsav és sósav keverékében reverzibilis reakciók fordulnak elő, amelyek lényegét általánosíthatja az egyenlet:
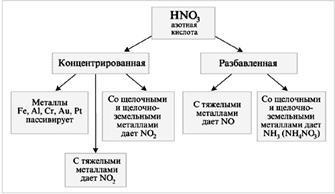

A keletkező atomklorid nagyon aktív és könnyedén kiválasztja az elektronokat a fém atomoktól, és a klorid ion stabil, komplex ionokat képez a kapott fémionokkal. Mindez lehetővé teszi az arany átvitelét a megoldásba. A koncentrált H2S04 erős dehidratáló szerként elősegíti a salétromsav és a nitrogén-oxid (IV) oxigén bomlását. A salétromsav az egyik erős szervetlen sav, és természetesen reagál a lúgokkal. Az oldhatatlan hidroxidokkal és bázikus oxidokkal is reagál [4].
A "Nitrogén" témakör tanulmányozása során. A nitrogénvegyületek "a kémia tankönyvét használják, amelyet a G.E. Rudzitis, F.G. Feldman, szintén a 9-es évekhez tartozó tankönyv, az N.S. Akhmetov. A didaktikus anyag egy kémiai könyv a 8-9. Évfolyamra, AM Radetsky által szerkesztett Gorshkov VP; A 9. fokozatú vegyi robotok feladatait az R.P. Surovtseva, S.V. Sofronova; A gimnázium kémiai problémáinak gyűjteménye és az egyetemek pályázata a G.P. Khomchenko, I.G. Khomchenko. A téma tanulmányozása 7 órát vesz igénybe [3, 5].
Menjen a fájl letöltéséhez