Termodinamikai wiki rendszer
Termodinamikai rendszer - megjelent (ténylegesen vagy mentálisan), hogy tanulmányozza a makroszkopikus fizikai rendszer. amely egy nagy részecskék számát, és nem igénylő annak leírását vonzási mikroszkopikus jellemzői az egyes részecskék [1]. „Része a világegyetem vagyunk szenteli, találjon” [2]. Az egység a részecskék száma termodinamikai rendszer általában szolgál az Avogadro-szám [3] (körülbelül 6 · október 23 részecskék egy mól anyagra) ad ötletet az értékek a szóban forgó rendelésre. Megkötés az anyag alkotó részecskék termodinamikai rendszer, nem fedik egymást: lehet atomok. molekulát. elektronok. ionok. fotonok és t. d. [4] [5]. Bármely tárgy látható szabad szemmel vagy optikai eszközök (mikroszkópok, teleszkópok, stb ....) tudható be termodinamikai rendszer, „termodinamika foglalkozik a tanulmány a makroszkopikus rendszerek, térbeli dimenzió és az, hogy elég hosszú ahhoz, hogy a szokásos feldolgozás mérése” [4 ]. Kapcsolódó makroszkopikus rendszerek közé tárgyak méretei 10 -7 m (100 nm) és 10 12 m [6]. Feltételesség alsó széle van társítva, többek között, hogy a termodinamika nem fontos objektum méretét, és a szám az azt alkotó részecskék. Cubic ideális gáz borda 100 nm normál körülmények között körülbelül 27.000 részecskék (lásd. Loschmidt állandó).
Bármely része termodinamikai rendszer úgynevezett alrendszert.
Minden termodinamikai rendszernek megvannak a maga korlátai. valós vagy feltételes, elkülönítve azt a környezetet [9]. Néha, ahelyett, beszél a környezet termosztát [4]. t. e. környezetben olyan nagy a hőkapacitása. hogy a hőmérséklete nem változik a hőcserét a vizsgált rendszert [10] [11] [12]. Alapértelmezésben azt feltételezzük, hogy a környezet elég nagy, ezért nem függ a paraméterek előforduló rendszer feldolgozza. Ezen túlmenően, mert általában úgy, hogy a környezet egy termodinamikai egyensúlyban, és jellemzői nem függ az idő és tér koordinátákat.
Fontos, hogy a termodinamikai rendszer tartalmazza az összes jelenlévő részecskék a lefoglalt helyet a kutatási területen. Az a tény, hogy a termodinamika néha ugyanazt a térfogatot tekintik elfoglalt egyszerre két vagy több kvázi-független (gyengén kölcsönható egymással) részleges alrendszerek részecskék különböző jellegű (például, egy gázkeverék jellemzi a parciális nyomások alkotó gázok; [13] a kristály és fonon bocsátanak ki a magnon alrendszer ;. rendszert magspinek jellemezve saját részleges, paramágneses centrifugálás hőmérséklet [14], amely képes felvenni a negatív értékek Kelvinben [15] [16] [17]). Ez lehetővé teszi, hogy vezessenek be egy hivatalos elfogadó alrendszer részleges jellemzői a részecskéket. Ez nem feltétlenül közvetlenül kapcsolódik a fizikai rendszer egészére (lásd. Például, a negatív abszolút hőmérséklet).
Osztályozása termodinamikai rendszerek [| ]
Természete által kölcsönhatás a környezet megkülönböztetni rendszert [9]:
- izolált. nem tud kommunikálni a külső környezet sem energiát, sem anyagot;
- adiabatikusan izoláljuk. nem kommunikál a külső környezet anyag, de lehetővé teszi a cseréjét energia formájában [18];
- zárt. cseréje energia a külső környezet, de nem cserél anyagot;
- nyitva. cseréje a környezet és energia, és az anyagot;
- részben nyitott. cseréje a környezet és az energia és az anyag, de amelyben nem minden komponensét résztvevő anyagok cseréjének az anyag (például, mert rendelkeznek féligáteresztő fal). [19];
A használt termodinamikai rendszer leírása állapot beállítások különböztethető meg: az egyszerű rendszerek. egyszerű, nyílt rendszerek és komplex rendszerek.
- Egyszerű rendszerek (. Egyszerű test [20] Thermodeformation rendszer [21]) olyan egyensúlyi rendszer, a fizikai állapota, amely teljesen által meghatározott értékek két független változó - tartalmaz egy egyszerű állapotban a test (x y.). így például, a hőmérséklet és a fajlagos térfogat értékeket (t. v) vagy nyomás és fajlagos térfogat (P. v). Expresszió jellemzőinek függvényében egyszerű, három test állapotban (x. Y. Z). Ez kölcsönösen független, az úgynevezett állapotegyenlet a test:
Egyszerű testek izotróp test (isos- egyenlő, TROPOS - irányban, mint egész - jellemzői az állam egyenletet és a fizikai tulajdonságait a test minden pontján minden irányban), beleértve: gázok, gőzök, folyadékok és sok szilárd anyag, termodinamikailag egyensúlyi és nincs kitéve az intézkedés a felületi feszültség, a gravitáció és az elektromágneses erők és kémiai átalakulások. Tanulmányok az egyszerű testek a termodinamika legnagyobb elméleti és gyakorlati érdeklődés.
Ha a anyagoknak a vizsgált rendszer a feltételeknek (nyomás. Hőmérséklet) kémiailag nem reagálnak egymással, a rendszer az úgynevezett fizikai. Ha a rendszer anyagok reakcióba lépnek egymással, akkor beszélünk kémiai rendszer [24] [25] [26].
Valódi termodinamikai rendszer elszigetelten a környezet segítségével végzik, falak (partíció. Partition felületek. Kagyló) [27]. mozgó és helyhez kötött, vízáteresztő és át nem eresztő anyag (vannak féligáteresztő septum). A Dewar-edény egy jó példa az adiabatikus héj. A partíció nem akadályozza a csere az energia, az úgynevezett diathermiás.
Termodinamikai rendszer homogénnek nevezzük. ha annak tulajdonságai folyamatosan változnak a pont-pont [28]. A homogén rendszerben azonos tulajdonságokkal bármely ponton homogénnek nevezzük [28]. Példák a homogén rendszerek, oldatok (gáz, folyékony és szilárd). A gázfázis mentén nagy hossza a gravitációs mező gradiens (például, a Föld légkörébe a felhőtlen és nyugodt nap) - például inhomogén homogén fázisban (lásd barometrikus képlet.).
Termodinamikai rendszer neve heterogén. ha több részből áll, különböző homogén tulajdonságokkal. A felületek elválasztó homogén részében heterogén rendszer, a rendszer tulajdonságai változik hirtelen [29]. Gyakran (de nem mindig) ezen a felületen látható.
A homogén részében heterogén rendszer úgynevezett fázis [29]. Kevésbé szigorú, de világosabban fázisok az úgynevezett „homogén része a rendszernek, elkülönül a többi a látható felületek a szakasz” [8]. Ennek egyik példája a rendszer „jég - víz - párás levegőt.” Homogén rendszer tartalmaz csak az egyik fázis; heterogén rendszer, amely két fázisból vagy több [30]. A fázisok számát heterogén rendszerben függ a Gibbs fázis szabályt. Egy és ugyanaz az anyag a szilárd halmazállapot lehet több fázis (rombos és a monoklin kén. Szürke és fehér ón, stb). [29].
Az ábrán az alábbi osztályozási termodinamikai rendszereket.
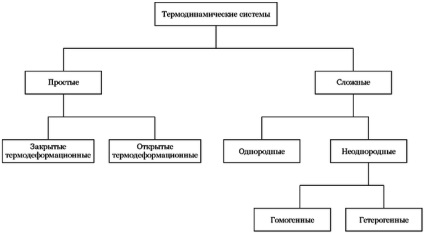
Az egyik lehetőség besorolása termodinamikai rendszerek
Lásd még [. | ]
Megjegyzések [| ]
Irodalom [| ]
A sorozat rövid jegyzeteket nem szerepel a cikkben, vagy nem vezet a „Hivatkozások” részben.