Időszakos Leeuw rendszer fényében az elmélet atomszerkezeti
1. Összetétel atomok. atomi szerkezetét modell.
2. Az állam a elektron egy atom.
3. A szerkezet a elektronhéjak atomok 1-4 időszakokban.
4. A függőség a tulajdonságai elemek az elektronikus konfiguráció. Elektronegativitás. Fémes és nem-fémes tulajdonságokkal.
5. A koncepció a kémiai kötés. Kommunikációs rendszerek: kovalens, ionos, fém. A polaritás a kapcsolatot. Valence. A szerkezeti képletek.
6. A kristályrácsban. A függőség az anyagok tulajdonságait, a rács típusát.
7. Az oxidáció mértéke. Redox folyamatokat.
Atom - a legkisebb kémiailag oszthatatlan részecskék, de a részecskeméret összetett szerkezettel bír. 1911-ben Rutherford bolygó modell atomszerkezetre javasolták. Egy kicsit később - 1913-ban volt az elmélet a Bohr. Ezek lényege, elméletek a következőképp alakul:
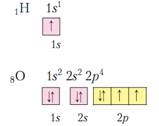
A központban az atom pozitív mag, elfoglal egy kis részét egy atom a tér. Mozgó elektronok az atommag körül, ezek alkotják az úgynevezett elektron héj. A teljes díj megegyezik a felelős az atommag, de ellentétes előjelű. Atom - elektromosan semleges részecskék.
atommag protonokból és a neutronok, ők nevezik nukleonokból. Különböző típusú atomok különböző számú protonok és a neutronok nevezett nuklidot. A nucleus tartalmazza szinte az összes tömegének az atom. proton tömege 1 amu neutron tömege 1 amu elektron tömeg = 1/1823 amu így a tömege az elektron héj elhanyagolhatóan kicsi összehasonlítva azzal a tömege a sejtmagba. A protonok száma az egy atom nevezzük a proton az atomok száma. Gyűjteménye atomok az azonos számú protont nevezzük kémiai elem. Proton szám egybeesik a sorszám az elem a MS. A nucleus pozitív töltésű, és mivel = 1 felelős a proton, neutron = 0, a felelős a mag meghatározzuk, és a protonok száma túl ordinális elem. Az összeg protonok és a neutronok az úgynevezett tömeges az elem számát. Mivel ez az összeg a protonok és neutronok tömegét határozza meg az atom. Sorszám (proton szám) és a tömeg (nukleonra) száma - a legfontosabb jellemzői egy atom. Kémiai elem jelzi, a jel, például: november 23. Na. Ha az azonos számú atomot protonok, de különböző számú neutronok, ilyen atomok nevezzük izotópok. Ie Na például 12-6 és június 13 S. Néha a másik oldalon a kémiai elem védjegy rögzített neutronok száma, azaz a egy 12, 6 - 12-6 P 6 és egy 13, 6 - 13-6 P 7 megkülönböztetni stabil és a radioaktív izotópok. Ismerve a tömeghányada az izotópok egy kémiai elem és tömegszám tudjuk számítani az átlagos atomtömeg az elem.
mert nukleáris díj megegyezik a töltés az elektron héj, és minden egyes elektron töltése (-1), a protonok száma megegyezik az elektronok száma. Ezek az elektronok mozognak az egyes pályákon az atommag körül.
Ez a modell az atom nagyon világos és hasznos. De a kérdés merült fel, azonnal. Az elektromágneses elmélet, mozgó olyan pályán gyorsulással elektron kell folyamatosan sugároz energiát, így akkor pörög és előbb vagy utóbb esik a sejtmagba. Ekkorra bebizonyosodott diszkrét elektromos energiát. Ezért, Bohr gondolta - keringő elektron nem sugároznak energiát, ez csak akkor történik során az átmenet az egyik orbitális a másikba.
Modern TCA folytán keletkeztek reflexió és kiegészítések Rutherford és Bohr. A legfontosabb, a fogalma volt, az elektron felhő, amely helyébe a koncepció egy elektron, mint a részecske. A modern elmélet atomszerkezeti figyelembe veszi a hullám tulajdonságait az elektron.
A kettős természetét az elektron. Mivel a részecske van egy bizonyos tömeg és töltés, és a hullám - a képesség, hogy körbejárja az akadály (diffrakciós). Az elektron nem lehet egyidejűleg pontosan mérni a helyzetét és az energia. Úgy mozog nagy sebességgel, és a természet az ő mozgását - a valószínűsége. Ie nem mozog egy bizonyos ütemterv és kaotikusan térben az atommag körül, és a valószínűsége tartózkodása különböző pontjain ezt a helyet változik. Ez a tér az atommag körül, ahol egy elektron tartózkodás legvalószínűbb az úgynevezett elektron felhő, vagy elektron pályák.
Pályáknak egy bizonyos méret, alak, és úgy vannak elrendezve a térben egy bizonyos módon. Jellemzésére a tulajdonságok e orbitális kvantum számot használunk. Már csak 4.
A főkvantumszám meghatározza a méret a pályák, és ezért azt a mértéket a távolság a sejtmagban. Ez a fő szám (orbitális méretű) a legtöbb energiát az elektron függ. Pályák megközelítőleg azonos méretű, hogy létrehozzák a elektron réteg (elektron szinten). Az n szám lehet értéke = 1,2,3,4 ... n, és a több, az érték, annál általában, az elektron energia. Gyakran a szerkezet az atom ábrázolva a diagram formájában:
azaz nátrium (№11) +11) 2) 8) 1
A szintek vannak osztva al-szintet. Sőt, a számos lehetséges sublevels egyenlő a szintek számát. Ie 1 alréteg szint 1, 2 - 2, 3, stb -3
Földalatti szintek vannak kialakítva pályák, azonos nemcsak méret, hanem alakú. Ez a forma meghatározza a második orbitális (orbitális) kvantum számát. Sublevels általában jelöljük betűt:
2. szint - 2s, 2p
3. szint - 3s, 3p, 3d
4. szint - 4s, 4p, 4d, 4f ...
A harmadik kvantum számot hívják mágneses, ez határozza meg a tájékozódás a orbitális térben és számuk a szintalatti. Számos ilyen -podurovnya s pályák minden szinten az 1. p-szintalatti - 3. d -5. F - 7 ...
A negyedik pályán szám jellemzi saját állapotában az elektron egy atom, amely egyszerűen, leírható, mint egy pillanat, self-forgás az elektron. Ez csak két értéket, azaz a (Egyszerűsített), vagy a forgási egy irányba, vagy a másik. Ez a jellemző az úgynevezett elektron spin és a szám - spin. Ie elektronok, amelyeknek három azonos kvantum számokat kell egy másik spin értéket.
1). Aufbau elv és az elv minimális energia; egy stabil (stacionárius) állapotban, elektronok töltse első orbitális alacsonyabb energia szinten. Az elektron energia mennyiségétől függ a tőke és orbitális kvantum számát, a emelkedő orbitális energiák alkotnak egy sorban:
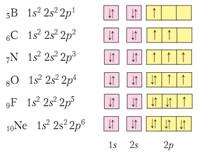
2). Az elv a nem Pauli atom nem lehet két azonos elektronok t. E. Az ugyanazon 4 kvantum számokat. Ezért egy orbitális nem lehet több, mint két elektron, ahol, a szemközti forog.
Pályák nagyjából ábrázolják sejtek - sejtek. És az egyik cellában húzunk vagy ↓ ↑. vagy csak ↓. vagy csak ↑. De ↑↑ - tilos a Pauli-elv.
3). Hund szabály. Egy szintalatti értéke a spin az elektronok legyen a maximum, ami azt jelenti, hogy a töltelék elektron szintalatti be előbb az egyik, és csak ezután - a párzási zajlik. - tilos!
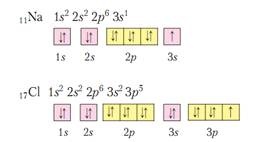
A formáció a kémiai kötések általában részt elektronok külső elektronikus réteg. Ezek az úgynevezett vegyérték. A elemei az alcsoportok az a kötés képzésében is részt vehetnek, és d-elektronok. Az elektronok száma a külső rétegben egy főcsoport (s és p komponensek) egyenlő a csoport szám egybeesik a maximális vegyértéke elem és a maximális oxidáció mértéke.
A legtöbb kis energiájú elektron konfiguráció van töltve egy elektron réteg - s 2 p 6 (egy réteg 1 s 2). (Kedvező energia sublevels is tele van, és félig töltött sublevels). Ezért minden olyan elemet hajlamosak, hogy fejezzék be az elektronikus réteget kell konfigurálni. Erre a célra az elemek adják, vagy vegyérték elektronok, illetve rögzítve vannak, figyelembe véve a többi atomok.
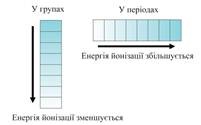

Elements magas EO nem-fémek.
Az EA időszakokban megnövekedett számának növelésével az alcsoportok - csökken. Lehívás tudta mérni az EO és ő elrendezve az elemek egy sorban:
Ismerve a helyzetét az elemet a PS, tudjuk jellemezni az elektronikus szerkezete és tulajdonságai.
Jellemzői PS elem (terv)
1) a helyzet a TS (a szekvencia száma, időszaka, csoport, alcsoport, atomsúlya)
2) a készítmény az atomok (a protonok száma, neutronok, elektronok)
3) az elosztó elektronok át a szinteken, sublevels, pályák (struktúra diagram elektron képletű kvantum sejt).
4) jellemző, az elektronikus szerkezete és tulajdonságai az elem és vegyületei (Számos elektrondonor rétegek, akár kitöltött külső elektronsugár réteg elektronok rajta, mit EO elem oxidációs jellemző, száma párosítatlan elektronok szabad pályák lehetséges vegyértékű elem jellemző elementa- vegyületek oxid-hidroxidok, LAN);
Következtetés: fémes vagy nemfémes tulajdonságait egy elem és egy összehasonlító elem tulajdonságai szomszédok időszakban és alcsoport.
Csak inert gázokat a szokásos körülmények között vannak egyatomos állapotban. Minden más célja, hogy fejezzék be a külső elektronikus réteg formájában kémiai kötéseket. Ez a vágy, hogy a 8. elektronok a külső réteg az úgynevezett oktett szabályt. Normális esetben, mielőtt egy kémiai reakció atom kell minél több energiát, és bemegy egy gerjesztett állapotban.
Kémiai kötés elektronikus jellegű, azaz által alkotott közötti kölcsönhatás a sejtmagok és elektronok az atomok. Van többféle kémiai kötések.
A kovalens kötés képződik általános elektronpár. Ez jellemző a nem-fémek, azaz, elemek magas EO.
Különböztesse poláris kovalens kötés, és egy kovalens kötés nem poláros (KP és CNR). Ha az atomok alkotó kapcsolat azonos, a elektronpár egyaránt tartozik mindkét atom, és a kötés az úgynevezett KNI. Ha az atomok különböző, a elektronpár van tolva, hogy több EO atom, atomok jelennek meg a részleges díjak, „pólus” kapcsolat CP.
Ha az elemek nagyon különbözik az EA, azaz fémek tartoznak az egyik, és a másik a nem-fémek, az elektronok teljesen át a több EO atommal, képeznek valódi díjakat a atomok. Atomok válnak ionok. Közötti kommunikáció az ionok a nevezett ionos.
Egyszerű anyagok - fémek alkotnak egy speciális típusú kémiai kötés, amely az úgynevezett fém. Ez hajtjuk vegyérték elektronok, amelyek közös tulajdonban összes fématomok (elektron gáz).
Sokaságát összekötő atomok együtt anyag. A szilárd állapotban lehet rendelni (kristályos) és egy rendezetlen (amorf) szerkezetű. Modell kristályos állapotban nevű anyag rács. Attól függően, hogy milyen típusú részecskék alkotnak rács típusú kémiai kötés, és az a szokás megkülönböztetni a molekuláris, ionos, atomi, és fém kristályrácsban. Minél erősebb a kötés a részecskék között, a nagyobb anyag olvadáspontja nagyobb keménységű. A poláris kötések, annál nagyobb a valószínűsége oldódását az anyag vízben.
Fontos jellemzője az elem annak oxidációs foka okisleniya.Stepen - ez kondicionált díjat. amelyek megjelennek a atom, ha minden elektronok képező kémiai kötéseket úgy mozdult el, hogy több elektronegatív atommal.