Környezeti hatások színes
mangán-ion Mn2 + nincs színező vizes oldatban. Eltávolítása két elektron a 4s-orbitális nem erős, de ez érinti a belső állapotát d-elektronok, Koto-ryh mangán mindössze öt és mindegyik az egyik öt lehetséges állapotok. Azonban magasabb oxidációs erős befolyása az elektronokat.
Kristályok MnSO4 vagy MnSOz színtelen (néha MnSOz rózsaszín), de oxid MnO szürkészöld, MnSl2 és Mn (NO3) 2 rózsaszín. Ha tengervizet létre rose-Weighted koncentrációja mangán, ez befolyásolja a kialakulását korallok, gyöngyök és gyöngyház. Japánban vannak speciális víz alatti ültetvény, ahol az idő-ólom gyöngyház kagyló - kagyló. Ezek az organizmusok a belső felületén héjak otklady-vayutsya aragonit lamelláris rétegek - az egyik kristályos formáját kalcium-karbonát (kb a második - kalcit - kapcsolatban említett cseppkövek). Ha ezek a rétegek tartoznak a mangánt, a rétegek kezdenek rózsaszínes árnyalattal és kiderül rózsaszín gyöngy. Tartalmazza más ionok kölcsönöz árnyalatot, és nagyon ritka gyöngy még fekete. Mivel gyöngyök sostaavu - kalcium-karbonát, akkor is előfordulhat földalatti barlangok. Barlangok New Athos volt obna-kell venni az ilyen gyöngyök egy meglehetősen jelentős összeget.
Mangán +3 oxidációs állapotban megfelel Mn2Oz barna vagy feketés barna Mn3O4. Azonban a utóbbi vegyületet tartalmaz nemcsak Mn3 +, de Mn4 +, amely mélyíti a színt. Szokásos körülmények között MnO2 - fekete kristályok. Mn6 + ion lehet jelen csak az anion MnO42- színű zöld. Kis-N2MnO4 sok ennek megfelelő anion szabad formában nincs kiválasztva, és képződik a sók savanyítás megoldások manganátokon:
K2MnO4 2SN3SOON + → + N2MnO4 2SN3SOOK
spontán tör egy sötétbarna MnO2 és permanganát KMnO4:
ZK2MnO4 + 4SN3SOON → MnO 2 + 2KMpO4 +
MnO4- anion, ahol a foka mangán oxidációs legmagasabb + 7 megfelel egy hosszabb - lila-bíbor színű. Mindenki látnia kellett - a színe a versenyek létrehozni „a kálium-permanganát.”
Ez a különböző színek mangán-vegyületeket, személyes idő-oxidáció és azok egyidejű kombinációja oldatban hagyjuk K. Scheele nevű K2MnO4 ásványi kaméleon. 1774-ben, a kutató kapott kálium-manganát fúziós:
MnO2 + 2KOH + KNO3, → K2MnO4 + KNO2 + H2O
A reakcióterméket vízzel adott egy zöld oldatot, de fokozatosan állás levegőn (alatti savanyú-fajta) először alakítjuk kék, majd-Fiol tovy és végül lett bíbor (színezés MnO4-).
Ilyen a különböző színek annak köszönhető, hogy a változó jellege a mangán ionok. A magasabb oxidációs állapotban, annál nagyobb a polarizáló hatását mangán. Jön az a tény, hogy Mn + M + 6 és 7 egyik erős oxidáló szerekkel. A víz ezek visszavonták oxigén-ion-wai CPNS környezetben magát a négy O-2 ionok. A különbség az állam egyetlen elektron határozza meg a színt - Seele-CIÓ vagy lila-bíbor, de más, mint hogy - az oxidatív-nek képességeit.
Valami hasonló történik a króm ionokkal. Hidratált krómiont Cr2 + kék. Ez az egyik az SA-Mykh erős redukáló szerekkel. Ez instabil vagy szol-re, vagy részeként egy szilárd anyagot kapunk. Az egyik a relatív, de tartós (a levegő távollétében) vegyületek - acetát Cr (SNzOO) 2. A polarizáló hatás a Cr2 + ion olyan, hogy acetát pirosra vált. Ion Cr2 + ne rAtE hajlamos Cr3 +, amelynek más a színe az oldatban - zöld, és néhány vegyület - lila (például, SrS1z). Nátrium-peroxidot oxidációja króm átvihetők a legmagasabb oxidációs állapotban +6:
2NaCrO2 + 3Na2O2 + 2H2O → 2Na2CrO4 + 4NaOH
Az ilyen SR6 + iont is tartalmazhat két anion Kitty Lot: króm - N2SrO4 és dikromáttal - N2Cr2O7. Minden mu megvan a maga sajátos színt: az első - sárga, és a második - narancs. Transzfer egyik formából a Dru-Guyu esetleges hozzáadásával savas vagy lúgos:
2CrO4- + 2H + → H2O + Sg2O72-
Cr2O72- + 2OH- → 2CrO42- + H2O
Természetesen, a króm, ami a legmagasabb oxidációs állapotban, - egy erős oxidálószer:
ZC2H5ON K2Cr2O7 + + 4H2SO4 → CH3CHO + Cr2 (SO4) 3 +
Az oxidáció mértéke határozza meg az állam a vegyérték elektronok. Minden oxidációs állapotban saját színe és jellege. Kékről instabil +2 ion, amelyek redukáló tulajdonságokkal SR6 + - oxidálószer áthalad a teljes szín. Tulajdonságainak módosítása ion és elszíneződés van ugyanazon az alapon - definiált-nek állapotában az elektronok. Az átmenet egyik fokú oxidok-MENT a másik teszi az elektronikus rendszer az ion-CHUV és érvénytelen a fénykvantumokat szigorúan meghatározott Ener-ology, különbségnek megfelelő energia d-sublevels. A különböző színek ionos államok ugyanazon elem bizonyítja, hogy a különbség elég finom. Ezek a színes programok léteznek egyéb átmeneti elemet. Példaként, mérhető színtér-nenie vegyületek - oxidok és vanádium-halogenidek oldatok (2. táblázat).
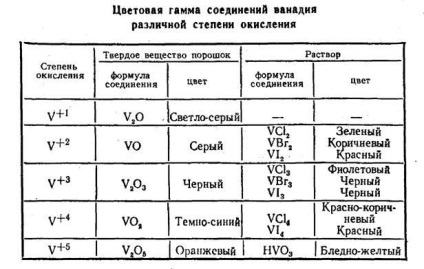
Elszíneződés megoldások összhangban az oxidáció mértékét jellemző és nemfémek. Például a jód a szabad állapotban van Mr. lila. Egy 100-százalékos kénsav oldatot jód is rózsaszín, ez korom-os állás komplex ion I3 +. Ez a komplex áll egy jód-molekula és adszorbeált kation I +, hozzáadásával oxidálószerként:
Nio3 2I3 + + + 8H2SO4 = 7I + + + + 8HSO4- ZN3O
Az oldat színe, ahol alapvetően ion I +, Stan-vitsya sötétkék.
Környezeti hatások színes
Kationok, anionok az oldatban héj veszi körül őket-stretching voritelya. A réteg ilyen molekulák közvetlenül szomszédsági tevő az ion nevezett szolvatációs héj (a szó megoldó - oldódnak). A beérkező molekulák itt meghatározott megosztásának nehéz. Mi azonban érdekel egy szolvatációját hatást.
Oldatokban ionok befolyásolhatja nemcsak egymással, hanem a környező oldószer-molekulát, és azok, viszont ionokra. Amikor feloldjuk az eredmények-Tate szolvatációs történik színe ion korábban színtelen. Például, vízmentes CuSO4 CuF2 és a fehér, és azok megoldásai kék. Ez a színeződés hidratált réz-ion. Kísérete tartalmaz mini-MUM hat vízmolekulák. Négyen vannak kötve vele határozottan, és két - gyenge. Cseréje ion környezete nehezen deformálódó F- és SO42- ionok jól polarizálható molekula víz vezet megjelenése színt. A víz eltávolítására (például elpárologtatással) eredményezi a csepp ki kristály hidrátok az azonos színű. Miután az összes, bennük vízmolekulák. Így, annak kristályos hidrátja a réz-szulfát CuSO4 • 5H2O négy az öt molekulák körül vannak elrendezve egy rézion és egy ötödik foglal egy közbenső helyzetben, és össze van kötve mind a Cu2 +, és egy csoport SO42- (ábra. 11).
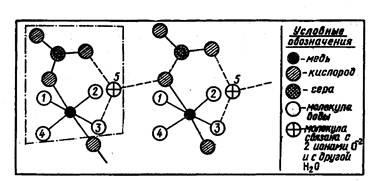
Ábra. 11. Az áramkör felépítése a kristályos szulfát-divat. A keret-ku fekszik egy molekula CuSO4 • 5H2O. Vonalkód azt jelenti, hogy a H2O molekula kapcsolódik két oxigén ionok és a másik Molek loi vizet.