Nitrogén Molecule - hivatkozási vegyész 21
Jelenlét. CO molekula hat kötőelektronok hiányában elektronok felelős széteső, mint nitrogén-molekula (ábra. 51), kialakulása egy hármas kötést tartalmaz. Ez magyarázza a jelentős hasonlóságokat a tulajdonságok a szabad nitrogén és a szén-monoxid, - panrimer, affinitás disszociációs energia (N2- 945, SB - 1076 kJ / mól), internukleáris távolságok molekulák (illetve 0,110 és 0,113 nm) ilavleniya hőmérsékleten (63 és 68 K) és a forráspontja (77 és 82 K). [C.150]
A disszociációs energia nitrogén molekulák egyedi atomok 945 KH1, w / mol. ha kötés a molekulában Nj egyenértékű Melyik 6oj annak n) Számítsuk ki az átlagos belső kötés energia elektronvoltos a kapcsolatot. [C.50]
Amikor szűkül, mivel az adszorpciós erők közeledik a pórusok falán vannak kialakítva, és a potenciális a diszperziós erők mindig növekszik. Ez növeli az energia a adszorpciós, különösen a molekulák nagy polarizálhatósága, például nagy méretű szénhidrogén molekulák és azok származékai. Az energia adszorpciós hexán és benzol gőzök szilikagélen jelentősen növeli a szűkülete a pórusok 50-40 A- adszorpciós Amikor kisméretű molekulák. így a metanol és a nitrogén molekulák, az adszorpciós energia észrevehetően megváltozik csak szűkülő pórusmérete kisebb, mint 30 A. Abban az esetben, vízadszorpciós szilikagélen pórusú szűkület 25 A-adszorpciós energia gyakorlatilag még nem érintett. [C.517]
Számos tudós jelzi a lehetőségét, hogy az energia a szabad nitrogénatomot és oxigén a légkörben lévő nagy magasságokban. Szabad nitrogén és az oxigén atomok hatására kialakuló, az ultraibolya sugárzás a nap magasságban 80-100 km. Nagyon alacsony nyomású olyan magasságban (körülbelül 0,01 Hgmm. Art és alább) szabad atomok a hosszabb tárolási időt. Ezért, ha a készüléket, amelyen lehet hozni társítani molekulák nitrogént és oxigént a motor, a repülőgép. leereszkedett a magassága 80-100 km, akkor gyakorlatilag kimeríthetetlen energiájuk. [C.96]
Az IR-frekvenciatartomány rakódhatnak molekula Ener-Gia sugárzást elnyelő két, három, vagy nagyobb számú foton (több foton, többfrekvenciás abszorpciós [146]). A molekula így szerez elég energiát disszociációs apró töredékek. A lézertechnológia is találtuk multifotonos ionizációs és töredezettsége poliatomos molekulák hatása alatt látható és az UV-sugárzás. Azt találtuk, hogy az oxigén is elnyelik a sugárzást az infravörös tartományban, a lehetőségét, a többfotonos abszorpciós nitrogén molekula, ami a disszociációs a molekula be atomok alapállapotú. [C.115]
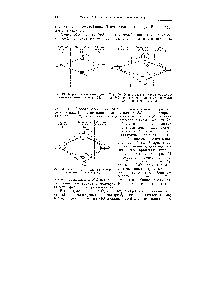
Nitrogén. A nitrogén-molekula. N2, valamennyi kötési pályák, energiaszintek ábrán láthatók. 12-8, töltik. Molekula N2 elektronikus konfiguráció [c.526]
Az alábbi Lewis szerkezetek molekulák nitrogén, N2, a legtöbb indokolt [c.590]
Ha a két egyenértékű héj, az energia változás a folyamat (16,29) egyenlő nullával (AE = 0). Mint kiderült, csak akkor kell változtatni ugyanaz az energia AE megfigyelhető az azonos helyettesítő mintát számának L-ionizált nitrogén molekulák. Kombinálása egyenlet (16,28) és a (16,29), kapjuk [c.350]
A vizes glükóz-oldat tartalmaz glükózt molekulák és a víz. Air áll a nitrogén-molekulák. oxigén és egyéb részecskéket. [C.13]
Így. nitrogén molekula három kémiai con-ri de ETN miatt egyenlőtlen az egyiket, és kéri, és két másik - l hívást. [C.90]
Így. .. A nitrogén-molekula 8-kötő és szétesést 2 elektront, azaz, a felesleges kötőelektronok 6 - a molekulában N2 amely egy hármas kötést. [C.105]
Eljárás heterofázisos szintézisét nitridek. amely tartalmazza a következő [3]. Anódos ív spot égő nitrogén alatt, közvetlenül a fém zár tablettát. helyezni egy lehűtött tégelybe. A fém megolvad, a nitrogénatom és a molekulák diffundálnak az olvadékba, és reagálnak, hogy kialakítsuk a nitrid. Ezen túlmenően, a fém részben elpárolog, és a nitrid képződik részben a gázfázisban. Képződik a felületén a fém-nitrid por szublimál több és összegyűjtjük egy vízhűtéses tekercs. Hozam termékek függ az aktuális erő és a nitrogénáram sebessége. [C.188]
A kísérleti igazolása a szóban forgó törvény, és végezze el a különböző egymástól független módszerekkel, teljesen megerősítette. Annak illusztrálására táblázatban. A 9. ábra a megoszlása a sebessége a nitrogén szobahőmérsékleten. [C.101]
Bár a rms sebessége nitrogén molekulák normális körülmények között, az 493 m cm. Ez nem jelenti azt, hogy a nitrogén-molekulák mozognak olyan sebességgel. Van egy eloszlása molekuláris mozgás sebessége. ahol vannak jól 1evaya sebesség, és a sebesség jelentősen meghaladó 493 m. Mivel a gázmolekulák folyamatosan ütköznek és a csere az energia, a sebesség folyamatosan változik. Ábra. 3-11 grafikusan ábrázolják a sebességeloszlás a molekuláris nitrogén gáz 1 atm nyomáson és különböző hőmérsékleteken. Pre- [c.142]
K, T. E. A gsch = 11,31, a magas fokú közelítése azt feltételezni, hogy az arány oszcillációs potenciális, entrópia és a hőkapacitása a nitrogén-molekula ezen tolsherature nulla. [C.192]
Tekintsük a kialakulását nitrogén molekula N2. Minden nitrogénatom három ns-g arenpymi 2p elektron e [c.134]
Ez könnyen belátható, hogy az egyenlőtlen változás sebességét előre és visszafelé reakciók társított 1em, hogy a bal és jobb oldalán az egyenlet ez a reakció változik a molekulák száma n-szigetek egy nitrogén-molekula, és három hidrogénatom molekulák (összesen négy gázmolekulák) alakítjuk két molekula ammóniát. Gáznyomás az eredmény az ő stroke molekulák érfal. ceteris paribus gáz nyomás nagyobb, minél hosszabb molakul közé zárt gáztérfogat. Ezért a reakciót előforduló növekvő számával gázmolekulák. Ez vezet a nyomás növelésével. és a reakció egy csökkentett számú [c.188]