Intermolekuláris kölcsönhatások - az
Az intermolekuláris kölcsönhatás elektromos jellegű, és áll a vonzóerők (orientáció. Indukálása és diszperzió), és taszító erők.
orientáció erő
Két elektromos dipól AB és CD az említett kölcsönös helyzetben vonzódnak, t. K. Ezzel ellentétes irányban díjakat a pont b és kölcsönhatásba több, mint az ugyanazt a díjat az A és C pontok (valamint b és d).
Tájékozódás erők hatnak közötti poláris molekulák, vagyis hogy nincs az elektromos dipólmomentum. A vonzóerő a poláros molekulák maximális abban az esetben, amikor a dipólus momentum vannak elrendezve egy vonal mentén (lásd. Ábra). Ez az erő annak a ténynek köszönhető, hogy a távolság a szemben hátba egy kicsit kevesebb, mint között az azonos nevet. Ennek eredményeként, a dipól vonzás meghaladja taszítás. dipól kölcsönhatás függ a relatív orientációja, és így szilárdsága orientációs nevezett dipól kölcsönhatás. Véletlen termikus mozgás folyamatosan megváltoztatja a tájékozódás poláros molekulák, hanem, mint a számítás, az átlagos összes lehetséges orientációban a erő értéke egy bizonyos értéket nem egyenlő nullával. A potenciális energia a tájékozódás a intermolekuláris kölcsönhatás:
ahol P1 és P2 - dipólus momentum a kölcsönhatásba lépő molekulák.
Ennek megfelelően, az erő a kölcsönhatás: Fop
Mert erőssége a távolsággal csökken sokkal gyorsabb, mint a Coulomb-erő közötti kölcsönhatás töltött testek (Fkul
indukciós erők
Indukciós (vagy polarizáció) erők hatnak a poláros és nem poláros molekulák. Polar molekula egy elektromos erőteret. molekula, amely polarizálja a villamos töltések egyenletesen vannak elosztva a térfogata. A pozitív töltéseket irányban eltolódik az elektromos mező, és negatív - ellen. Ennek eredményeként, a nem-poláris molekuláknak indukált dipólmomentum.
Az energia az intermolekuláris kölcsönhatások ebben az esetben arányos a dipólusmomentuma a poláris molekula P1 és polarizálhatóság a2, azzal jellemezve, hogy a képesség, hogy polarizálja másik molekulához:
Ez az energia az úgynevezett indukciós. mivel úgy tűnik, mivel a polarizáció a molekulák okozta elektrosztatikus indukció. Indukciós erők (Find
R -7) is működnek, között poláros molekulák.
diszperziós erők
Két nem-poláris molekuláknak, hat diszperzió intermolekuláris kölcsönhatást. A természet ezt a kölcsönhatást már tisztázott teljesen csak létrehozása után a kvantummechanika. Az atomok és molekulák egy bonyolult módon, elektronok mozogni a magok. Az idő átlaga dipólusmomentumának nem-poláris molekuláknak nullával egyenlő. De minden alkalommal, az elektronok elfoglalni egy bizonyos helyzetben. Ezért, a pillanatnyi értéke a dipólus momentum (például a hidrogén-atom) értéke nem nulla. Pillanatnyi dipólus egy elektromos erőteret, amely polarizálja a szomszédos molekula. Ennek következtében felmerül kölcsönhatás dipólus instant. A kölcsönhatási energia közötti nem-poláris molekulák átlagos interakció eredményeként minden lehetséges instant dipólusok a dipólus momentum, amelyek indukált a szomszédos molekulák indukció. A potenciális energia a diszperzió molekuláris kölcsönhatás:
A1A2 / R6 és Fdisp
R -7 (itt A1 és A2 - polarizálhatóságot kölcsönható molekulák).
Intermolekuláris kölcsönhatások Az ilyen típusú úgynevezett diszperziós úgy, hogy a diszperzió a fény egy közeg tulajdonságai határozzák meg a molekulák, hogy ezt a kölcsönhatást. Diszperziós erők aktus közötti összes atomok és molekulák, valamint a mechanizmus a megjelenésük nem függ, hogy a molekulák (atomok) állandó dipólmomentum vagy sem. Általában ezek az erők kiváló nagyságrendű, mint az orientációs és indukciós. Csak a kölcsönhatása molekulák nagy dipólus momentum, mint például a víz molekulák, For> Pdisp (3-szor a vízmolekulák számára). Amikor a kölcsönhatás a poláris molekulák, mint például a CO. HI. HBr és más diszperziós erők meghaladják az összes többi több száz alkalommal.
Lényeges, hogy mind a három fajta intermolekuláris kölcsönhatások ugyanúgy csökken a távolság:
U = UOP + + Uind Udisp
taszító erő
A taszító erők a molekulák közötti nagyon rövid távolságokon, amikor érintkezésbe lépnek töltött elektronhéjakat atomok szerepel a molekulákat. Meglévő kvantummechanika Pauli-elv tiltja behatolását a megtöltött elektronhéjak egymásra. Emerging a taszítóerők függ, hogy nagyobb mértékben, mint a vonzóerők az egyedi molekulák. Jó egyezést mutat a kísérleti adatokból azt a feltételezést, hogy a potenciális energia taszító kényszeríti UOT csökkenésével növekszik távolság jog:
A kapott kölcsönhatás
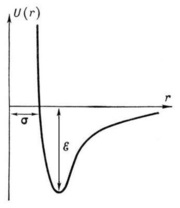
Függőségi potenciálra U (r) intermolekuláris kölcsönhatás Lennard-Jones a távolság R molekulák közötti. A távolság r = σ - a lehető legkisebb távolságot a rögzített molekulák, ε - mélység „potenciális jól” (energia a molekula).
Ha feltételezzük, hogy az U (r) = 0, r → ∞, és úgy vélik, hogy a vonzás energia csökkenésével csökken távolság arányos R -6. és a taszítás energia megnövekszik, amikor r -12. a görbe U (r) lesz a ábrán bemutatott formában. Potenciális energia minimális távolságnak felel meg, amely felett a molekuláris kölcsönhatást erők nulla.
Számítsuk ki a kvantummechanika alapján a kölcsönhatásba lépő molekulák gyakorlatilag lehetetlen nagy változatossága pár kellő pontossággal U (r). Nem lehet még kísérletileg mérni az erejét intermolekuláris kölcsönhatások távolságon. Ezért általában úgy választjuk meg, képlet U (r), meg kell tenni a segítségével a számítások jól lehet összhangban a kísérletet. A leggyakrabban használt képlet:
U (r) = 4ε ((σ / R) 12 - (σ / R) 6)
az úgynevezett Lennard-Jones potenciál. A képlet σ és ε értékeket határozzuk meg kísérletileg alapján a függőség Az anyagok tulajdonságainak (például, diffúziós együtthatók. Vezetés vagy viszkozitási) a σ és ε.
Van der Waals-egyenlet
Van der Waals azt javasolta, hogy közelről (r) a molekulák közötti taszító erők aktus, amely helyettesíti a távolság növelésével vonzóerő. Alapján ezek a gondolatok nélkül is figyelembe véve a mennyiségi függését az intermolekuláris kölcsönhatás a távolság, ez volt az úgynevezett Van der Waals állapotegyenlet egy igazi gáz.
Lásd, amit a „intermolekuláris kölcsönhatások” más szótárak:
Intermolekuláris kölcsönhatások - kölcsönhatást. molekulák egymás között, nem eredményezi az elszakadást vagy az újabb kémiai. kapcsolatokat. M. a. Ez határozza meg a különbség az ideális reális gázok, folyadékok és a létezés mol. kristályok. M. a. függ inkább. szerkezeti, spektroszkópiai, termodinamikai ... Chemical Encyclopedia
NEVALENTNYE kölcsönhatás - atomi kölcsönhatás független kémiai. kommunikáció. A klasszikus. kémiai elmélet. struktúra Geom. konfigurációk a molekula közel egyensúlyi, azt feltételezzük, lehetséges alternatív elválasztási kölcsönhatásait alkotó atomok a molekula, két ... ... Chemical Encyclopedia
Van der Waals erő - Van der Waals erők intermolekuláris erők (és atomközi) kölcsönhatás energiája 10 20 kJ / mól. Ez a kifejezés eredetileg kifejezés minden ilyen erők a modern tudomány is általában ... Wikipedia
Az intermolekuláris kölcsönhatás - intermolekuláris kölcsönhatás közötti kölcsönhatás elektromosan semleges molekulák vagy atomok. Ez volt az első helység JD van der Waals 1873. Számvitel intermolekuláris erők magyarázatra szorul, az ingatlan valós gázok és ... ... Wikipedia
MOLECULAR A komplex - (. Donor-akceptor komplexek mol vegyület) vannak kialakítva: formális vegyérték ült. molekulák intermolekuláris erők. Sovrem. bemutatása M. a. sokkal szélesebb, mint a megállapított nevüket, hogy van. Hogy. A M. Hogy. a ... ... Vegyi enciklopédia
Atomok közötti kölcsönhatás - közötti kölcsönhatás a atomjai mind szabad, mind a tagjai azonos vagy különböző molekulák, kristályok, stb M. c ... lehet, hogy körülbelül egy l e n t N u m, és az O N m, m e t a l l és H E C k és m, mint például egy d p o n n o D egy I h és egy n d e p ... in ... Fizikai enciklopédia
Molekuláris spektrum - az emissziós spektrumok, abszorpciós és Raman-szórás (RS) tartozó szabad vagy lazán kötött egymáshoz molekulák. Tipikus M. o. csíkos, ezek tiszteletben tartását, mint egy sor többé-kevésbé keskeny sáv az ultraibolya, látható és ... ... Fizikai Enciklopédia
MOLECULAR KRISTÁLYOK - alakított molekulákat kötött van der Waals-erők (intermolekuláris kölcsönhatás cm.). Atomok kapcsolódnak a molekulákon belül lényegesen nagyobb (kovalens) kötések. Fázisátalakulások M .. Olvadás, szublimáció polimorf átmenetek ... ... Vegyi enciklopédia
Molecule - (novolat molecula, apró lat mól tömege ..) A legkisebb szemcse egy anyag, amelynek kémiai tulajdonságai. M. atomokból áll, pontosabban a atommagok, elektronok körülvevő belső és külső vegyérték elektronok ... ... a nagy szovjet Encyclopedia