Az oxigén (gáz) - van
oxigénatom reakcióvázlat
Ugyanakkor Priestley eleinte nem veszik észre, hogy ő fedezte fel egy új, egyszerű anyag. úgy véljük, hogy az egyik elkülönített alkatrész a levegő (és ez a gáz az úgynevezett „dephlogisticated levegő”). Az ő felfedezése Priestley közölte a kiváló francia vegyész Antoine Lavoisier. 1775-ben Lavoisier megállapította, hogy az oxigén egyik összetevője a levegő, savak, és megtalálható sokféle anyagot.
Így, az oxigén nyitó érdeme ténylegesen megoszlik Priestley, Scheele és Lavoisier.
A név eredete
Szó oxigén (megnevezett elején a XIX században még „kislotvorom”), hogy annak megjelenése az orosz nyelv kötelező a Lomonoszov - egy tervezet a „oxigén” (Fr. l'Oxygene.) Által javasolt, Lavoisier (a görög όξύγενναω ὀξύς - « savanyú „és γενναω -« született »), amely fordítva« sav generátor »amely kapcsolatban van a kezdeti érték -« sav”, a korábban vélelmezett oxidok, a továbbiakban: a jelenlegi nemzetközi nómenklatúra-oxidok.
Mivel a természetben
Jelenleg az iparban oxigént kapott levegőt. A laboratóriumokban, ipari oxigént vannak táplálva acélhengereket nyomáson körülbelül 15 MPa. A legfontosabb laboratóriumi módszer a termelés a vizes oldatok elektrolízisével a lúgok. Kis mennyiségű oxigént is elő, hogy egy oldatot a kálium-permanganát-oldattal megsavanyítjuk hidrogén-peroxid. Az is jól ismert, és sikeresen alkalmazzák az iparban oxigén növények. alapján működő, a membrán és a salétromsav tehnologiy.Pri KMnO4 kálium-permanganát fűtési bomlik K2 MnO4 kálium-manganát és a mangán-dioxid MnO2 egyidejű fejlődése oxigéngáz O2:
Laboratóriumi körülmények között is elő katalitikus hidrogén-peroxid bomlását H2 O2:
A katalizátort előnyösen mangán-dioxiddal (MnO2), vagy egy darab nyers zöldségek (tartalmaznak enzimeket. Fel kell gyorsítani a hidrogén-peroxid bomlását).
Oxigén is előállíthatjuk katalitikus bomlása kálium-klorát (kálium-klorát) KClO3:
A katalizátort is működik MnO2.
Hideg víz tartalmaz több oldott O2
fizikai tulajdonságok
Normális körülmények között az oxigén gáz nélkül színe, íze és illata. 1l súlya 1,429 g kissé nehezebb, mint a levegő. Vízben kismértékben oldódik (4,9 ml / 100 g, 0 ° C-on, 2,09 ml / 100 g 50 ° C-on) és az alkohol (2,78 ml / 100 g 25 ° C-on). Könnyen oldódik a megolvadt ezüst (22 térfogat O2 1 térfogat Ag át 961 ° C-on). Ez paramágneses.
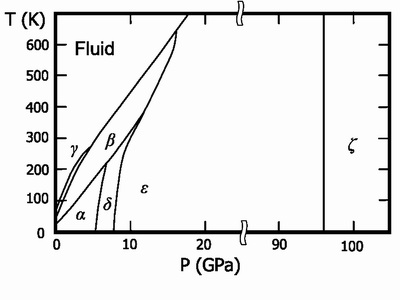
Szilárd oxigén (olvadási hőmérséklet -218,79 ° C) - kék kristályok. Ismert 6 kristályos fázisok. 3. amelyek léteznek nyomáson 1 atm.
- α-O2 alatti hőmérsékleten -249,35 ° C, világos kék kristályok, ortorombos rendszer. cella paraméterei a = 5,50Å, b = 3,82Å, c = 3,44Å;
- β-O2 hőmérsékletét -249,35 hogy -229,35 ° C, halvány kék kristályok, színét, ha a nyomás rózsaszínűvé válik, romboéderes kristály rendszer, a = 6,19Å, α = 99 ° 6;
- γ-O2 -229,35 hőmérsékletet -218,79 ° C, halvány kék kristályok, köbös kristály rendszer, a = 6,83Å;
Újabb három fázis képződik nagy nyomásokon:
- δ-O2 hőmérséklet-tartományban legfeljebb 300 K és nyomása 6-10 GPa. narancsszínű kristályok formájában;
- ε-O2 nyomás 10 és legfeljebb 96 GPa, kristály színe sötétvörös vagy fekete, a monoklin kristály rendszer;
- ζ-O2 nyomás magasabb, mint 96 GPa, fémes állapotban, jellegzetes fémes csillogás, alacsony hőmérsékleten, válik szupravezető.
kémiai tulajdonságok
- Erős oxidálószer, reagál gyakorlatilag minden elemét alkotó oxidokat. A oxidációs állapota -2. Jellemzően, az oxidációs reakció a hőfelszabadulás és gyorsabb magasabb hőmérsékleten. Példa reakciók előforduló szobahőmérsékleten:
- oxidálja tartalmazó vegyületek tartoznak, melyek nem maximális oxidációs állapotban:
- oxidálja a legtöbb szerves vegyületek:
- Bizonyos körülmények között lehetőség van elvégzésére „finom” oxidációs szerves vegyületek:
- Oxygen nem oxidálódik Au és Pt. halogének és inert gázok.
- Oxigén formák peroxidok oxidációs állapotban -1.
- például peroxidok elégetésével nyernek alkálifémek a oxigén:
-
- az égés által kidolgozott elmélet Bach és H. A. Engler, oxidáció két lépésben megy végbe, hogy egy köztes peroxi-vegyületet. Ezt a közbenső terméket izolálhatjuk, például a hidrogén-égő láng jeges hűtés, a vízzel együtt, hidrogén-peroxid keletkezik:
- Szuperoxidok foka oxidációs -1/2, azaz egy elektron két oxigénatomhoz (O2 ion -). Peroxidok állítjuk elő oxigénnel megemelt nyomáson és hőmérsékleten:
- Ozonidok tartalmaznak O3 ion - egy oxidációs fok -1/3. Hatásával nyert ózon az alkálifém-hidroxid:
- Dioksigenil O2 + ionnal is van egy oxidációs +1/2. Állítjuk elő:
- oxigén-fluoridok
- oxigén-difluorid. OF2 oxidációs állapota +2, úgy állítjuk elő, halad fluor- keresztül lúgos oldat:
-
- monofluoride oxigén (dioxigén-difluorid), O2 F2. instabil oxidációs állapotban +1. Egy keverékből állítjuk elő a fluor és oxigén parázsfénykisülést hőmérsékleten -196 ° C-on
- Átugrása parázsfény keresztül keveréke fluor és oxigén bizonyos nyomást és a hőmérsékletet így kapott reakcióelegyet a magasabb O3 F2 oxigént fluoridok. O4 F2. O5 és O6 F2 F2.
- támogatják a légzés folyamatok, égés, rothadó
- létezik két allotropic módosításokat: O2 és O3 (ózon)
kérelem
Széles ipari oxigén alkalmazások kezdődött a huszadik század közepéig feltalálása után a turbinák - eszközök cseppfolyósító és szétválasztása cseppfolyós levegő.
A kohászati
Converter acélgyártó eljárás során az oxigént.
Vágó- és hegesztés fémek
Oxigén széles körben használják a hengerek láng vágó és hegesztő fémek.
A folyékony oxigén, mint oxidálószer használják hajtógázok. hidrogén-peroxid. salétromsav és más oxigén gazdag vegyület. A keveréket a folyékony oxigént és folyékony ózon - az egyik legerősebb oxidálószerek hajtógáz (specifikus impulzusa hidrogén elegyet - ózon meghaladja a specifikus impulzusa a páros -fluor hidrogén -fluoriddai oxigén és hidrogén).
Az orvostudományban,
Az oxigén dúsítás használják légzőszervi gázkeverékek (aeronetiki) megsérti a légzést. az asztma kezelésére. formájában oxigén koktélok, oxigén táskák és így tovább. d.
Az élelmiszeriparban
Az élelmiszeriparban, oxigént regisztrált mint élelmiszer-adalékanyag E948 [1]. a hajtógáz és a csomagolás.
A biológiai szerepe az oxigén
Élőlény lélegzik oxigént. Oxigén széles körben használják a gyógyászatban. A szív- és érrendszeri betegségek, hogy javítja az anyagcserét, oxigént juttatunk be a gyomorba hab ( „oxigén koktél”). Szubkután injekció oxigén használt trofikus fekélyek, elefántiázis, gangréna és más súlyos betegségek. Fertőtlenítésére és szagtalanítására levegő és a tiszta ivóvíz használnak mesterséges dúsítás az ózon. A radioaktív izotóp 15 O oxigén vizsgálatára felhasznált vér áramlási sebessége, a légzést.
A toxikus oxigén-származékok
Néhány származékai oxigén (azaz. N. reaktív oxigén fajták), mint például a szinglett oxigén. hidrogén-peroxid. szuperoxid. ózon és hidroxil gyök. Ezek rendkívül mérgező termékek. Ezek során keletkező aktivációs vagy részleges csökkentése az oxigén. Szuperoxid (szuperoxid-gyök), hidrogén-peroxid és a hidroxil gyök lehet előállítani a sejtekben és szövetekben az emberi és állati szervezet és oxidatív stresszt okoznak.
Vannak radioaktív izotópok 11 O, 13 O 14 O (felezési ideje 74 másodperc), 15 O (T1 / 2 = 2,1 perc), 19 O (T1 / 2 = 29,4 másodperc), 20 O (ütköző adatokat felezési 10 perc és 150 év).
érdekes tények
- oxigén molekula szobahőmérsékleten az átlagos mozog szuperszonikus sebesség 480 méter másodpercenként. [2]
Nézze meg, mit „oxigén (gáz)” más szótárak:
OXYGEN - gáz a víz formájában oldott molekulák. Jelenléte előfeltétele a létezését a legtöbb élő szervezetek a vízben. Nyáron, az összeg a K vizet folyamatosan pótoljuk a légkörből, és azáltal, hogy ... ... tógazdasági
Oxigén - Ebben a kifejezés, vannak más célokra, az Oxigén (egyértelműsítő lap) .. 8 Nitrogén Oxigén ← → fluorid ... Wikipedia
oxigén - egy; m. kémiai elem (O), a gáz, színtelen, szagtalan, része a levegő szükséges a légzés és az égés és alkotó hidrogénnel kombinált vízzel. ◊ Intersect oxigént ki l. Készítsen elviselhetetlen életkörülmények, a munka. ◁ oxigén ... ... kollégiumi szótár
OXYGEN - (latin Oxygenrum) kémiai elem; Mintegy szimbólum; atomszámú 8, a relatív atomtömeg a 15.999. Normális körülmények között, az oxigén gáz színtelen és szagtalan. Szokásos körülmények között végzett kétatomos oxigén molekula (O2); Egy csendes elektromos ... ... Kohászati szótár
Oxigén - oxigén, a legkönnyebb elem VI csoportba a periódusos rendszer, Char. Ó, a sorozatszámot 8. K. gáz nélkül színe, szaga és íze. Izotóp. Am. a. 16,000 mol. a. 32.000. Sp. a. K képest a levegő 1,10535; 0 ° és 760 ... Nagy Medical Encyclopedia
OXYGEN - (Ohugenum). Színtelen gáz szagtalan és íztelen. Ez oldódik vízben (körülbelül 01:43). belélegzett oxigént széles körben használják különböző járó betegségek hipoxia: légzőszervi betegségek (tüdőgyulladás, tüdő ödéma, gyógyszerek ... szótár
OXYGEN - (Oxygenium), O, egy kémiai elem VI csoport a periódusos rendszer, atomszáma 8 atomtömeg 15,9994; gáz, B.P. 182,962shC. Az oxigén a leggyakoribb elem a légkörben 23,10 tömeg% szabad oxigén hidroszféra és ... ... Modern Enciklopédia
OXYGEN - (lat Oxygenium.) Egy kémiai elem VI csoport a periódusos rendszer, atomszáma 8 15,9994 atomtömeg. A szabad formában megtalálható formájában két módosítást O2 (normál oxigén) és O3 (ózon). O2 gáz színtelen, szagtalan, a sűrűség 1,42897 ... ... kollégiumi szótár
Oxigén - a leggyakoribb elem a földkéregben. Sauder. ez 49,13 tömeg és 91,8 térfogat%. A litoszféra tartalmaz. C. 47 tömeg%, a hidroszférát 85,89% és 23,01% a légkörben. A túlnyomó többsége atomok K. (körülbelül 99,99%) magas kémiai. ... ... Geológiai Encyclopedia
Oxigén (oxigénatom) - gáz, színtelen, szagtalan, alkotják egyötöde a légköri levegő. Az oxigén nélkülözhetetlen az élethez, a legtöbb élő organizmusok, mint során vegyületei glükóz (vagy néha más típusú üzemanyag energiaforrások) a ... ... orvosi terminológia
- Oxigén. Jesse Russell. Ez a könyv lesz összhangban a rendelését Technology Print-on-Demand technológiát. Figyelem! A könyv a gyűjtemény anyagából Wikipedia és / vagy más online forrásokból. ... Tovább Vásárlás 998 rubelt
- Oxigén az életünkben. AY Axelrod. Köztudott, hogy az oxigén - a „gáz” az élet. De miért a test sejtjeit az oxigén? Mennyi oxigén a személy kell egy perc alatt? Egy óra múlva? Abban az évben? Mi az a „oxigénhiány”, és hogyan kell harcolni ... Tovább Vásárolja 140 rubelt
- Lenyűgöző kémia. Gyermek kiadói Elena. Meet "Lenyűgöző Chemistry"! Végén ezt az utat nagybátyja Kuzma és Chevostik kelt a leggyakoribb konyhai néhány kémiai kísérletek. Ez - egy nagyon izgalmas élmény, és azt akarom, hogy különösen ... Tovább Vásárlás 126 rubelt hangoskönyv