Abstract folyamatok, egyesíti és hasítás oxiklórozási klórozott, tartalom platform
1. Áttekintés A halogénezési eljárás 4
2. Biztonság halogénezési folyamatok 9
3. Eljárás Chemistry and Technology 10
Irodalom 12
Gyártása szerves keletkezett egy nagyon hosszú idő, de eredetileg azt feldolgozásán alapuló növényi vagy állati nyersanyagok - anyagok kiválasztása (cukor, olaj) vagy a hasító (szappan, alkohol és mások.). Organic Synthesis, t. E. A készítmény az összetettebb anyagok egy viszonylag egyszerű, eredetileg a közepén XIX alapú mellékterméke kokszszénhez tartalmazó aromás vegyület. Ezután már a XX században, mint a forrás szerves alapanyagok egyre fontosabb szerepet játszanak az olaj és a földgáz, a bányászat, a szállítás és a feldolgozás, amely sokkal gazdaságosabb, mint a szén. E háromféle fosszilis nyersanyagok alapja elsősorban az ipar és a szerves szintézis. A folyamatok fizikai elválasztási, vagy termikus katalitikus hasítással (kokszolás, repedés, pirolízis, reformáló, konverziós) kapott öt csoport a kiindulási anyagok szintézisére sok ezer más vegyületek:
1. A paraffinok (a metán CH4 szénhidrogének C15 - C40);
2. olefinek (C2H4, C3H6, C4H8, S5N10);
3. Aromás szénhidrogének (benzol, toluol, xilolok, naftalin);
5. a szén-monoxid és a szintézisgázt (keveréke CO és H2).
A fejlesztés a szerves szintézis ipar volt osztva több szektorban (színezék technológia, gyógyszerek, műanyagok, rostok, stb), amelyek közül fontos helyet az ipar alapvető szerves és petrolkémiai szintézis. A „nagy” (vagy „kemény”) gyártására vonatkozik szerves szintézis mnogotonazhnyh termékeket, amelyek alapját a többi szerves technológia. Másfelől, a „petrolkémiai” szintézissel kapcsolatban megjelent szerves anyag transzformációs technológia kőolaj-alapanyagot a szokásos értelemben vett (kivéve előállítására szervetlen anyagok és polimerek) lefedi az elsődleges kémiai finomító ásványolaj eredetű szénhidrogének. Ebben a tekintetben, ez része a szerves szintézis, és ez annak köszönhető, hogy azok együttes tetején.
1. Áttekintés a halogénezési eljárás
1. Halogén elő három fő módja van: a-elmozdulások, szerelés és felosztása.
Helyettesítés (szubsztitúciós) halogénezés helyettesítés halogénatommal más atomok vagy csoportok. Ezek a legfontosabb a helyettesítése hidrogénatomok
RH + CI 2 → RCI + HCl
ami előfordulhat, mind telített és telítetlen szénatomot tartalmaz, vagy egy aromás mag. Az a képesség, hogy-scheniyu helyébe tároljuk különböző szénhidrogén-származékok.
Helyettesítése egy halogénatommal másik fontos megszerzésének fluor-, bróm- - és yodoproizvodnyh több hozzáférhető szerves klórvegyületek:
CCl4 + 2HF → CCI2F2 + 2HCI
RCI + NaBr → R-Br + NaCl
Cseréje az OH - csoport, halogénatom előállítására használják néhány halogén és savkloridok:
ROH + HCl → RCI + H2O
RCOOH + COCI2-vel → RCOCI + CO2 + HCl
Csatlakozó (additív) halogénezőszerrel - összekötő halogénező szerek a telítetlen vegyületek rendelkezik hasonlóan nagy gyakorlati jelentősége, mivel a helyettesítés. Szabad halogének képes csatlakozni a C = C S≡S és Sar-Sar:
CH2 = CH2 + CI2 → CICH2-CH2CI
CH≡CH + 2CI2 → CHCI2-CHCI2
C 6 H 6 + 3 CI 2 → C 6 H 6 Cl 6
Halogenidek kapcsolódnak a kettős és hármas kötéseket (gidrogalogenirovanie) és olefineket is reagálnak hlorgidrirovaniya:
CH2 = CH2 + HCl → CH3-CH2CI
CH≡CH + HCl → CH2 = kloroformban
CH2 = CH2 + CI2 + H2O → CH2CI-CH2OH + HCl
Az a képesség, egy adalékanyag a fenti halogénezési reakciók mentett számos származékai, telítetlen szénhidrogének.
Egy különleges eset az adalék klórozása kapcsolódási klóratomok az az alacsonyabb vegyértékű állapotukban, például foszgént szintézis szén- monoxidból és klórt:
CO + CI 2 → COCI 2
klórozott hasítási reakciók egyre fontosabbá válik. Ezek a legtöbb könnyen bekövetkezik dehidroklórozásán (1), fordított HCI hozzáadásával. Mivel a preferencia e reakció más hasítási folyamatok során csak magas hőmérsékleten perhlorproizvodnyh. Ez - diklórszármazékká (2) CI 2 fordított kapcsolat és hasítását a szén-szén kötést tartalmaz, amelyek mellett előfordulhat az intézkedés a klór - chlorolysis (3) vagy hlorinoliz vagy megnövelt hőmérsékleten - pirolízis (4):
CH2CI-CH2CI CH2 = kloroformmal + HCl
CCI3-CCI3 CCI2 = CCI2 + CI2
CCI3-CCI3 + CI2 2CCI4
CCI3-CCI2-CCI3 CCl4 + CCI2 = CCI2
2. termodinamika halogénezési reakciók
halogénezési reakciók nagyon különböző teljesítmény jellemzőinek, amely meghatározza azok fontos jellemzőket. Az alábbiakban hőhatások képest képződésével járó reakciókat fluor-, klór-, bróm- és jód-egy ideális gáz állapotban anyagok:
Amint a fenti adatokból látható, a termikus hatás csökken egy sor F 2> Cl 2> Br 2> I 2. ahol különleges helyet foglalnak el a fluorozási reakció, és a jódozás. Először kíséretében nagyon magas hő nagyobb, mint az energia különbség a C-C és a C-H. Ha nem, hogy különleges intézkedéseket, ez ahhoz vezet, hogy egy mély szerves anyagok lebontása. Másrészt, jódozás végbemegy nagyon kicsi vagy negatív termikus hatás, és reakciókkal ellentétben fluor-, klór- és brómatom, reverzibilis. Ez együtt az alacsony aktivitás a jód, mint a reagens okok kapnak yodoproizvodnye más módon. Azonban, azok elő a kis léptékű, és nem tartozik a termékek alapvető szerves és petrolkémiai szintézis.
Termikus hatások néhány reakciót, amely a hidrogén-halogenidek, és ideális gáz halmazállapotú anyagok a következők:
C 2 H 4 + HF → C 2 H 5 F ()
C 2 H 4 + HCl → C 2 H 5 Cl ()
C2H4 + HBr → C2H5Br ()
C2H4 + HI → C2H5I ()
C 2 H 5 OH C 2 H 5 Cl ()
Mindezek a reakciók exoterm, és a halogenidek a különbség kisebb, mint a szabad halogének. Fontos, hogy az összes reakciót, amely hidrogén-halogenidek reverzibilisek.
3. halogénező szerek
A legmagasabb érték, mint például a következő halogénezőszerek halogénmentes és vízmentes hidrogén-halogenidek. A forráspont légköri nyomáson mutatjuk be az 1. táblázatban.
A forráspontja hidrogén-halogenideket és halogének atmoszférikus nyomáson
Mindegyikük oldódnak szerves folyadékok (Br 2> Cl 2> F 2 és HBr> HCI> HF), ami nagyon fontos a folyékony fázis számára halogénezési eljárásban. Van egy szúrós szagú, irritálják a nyálkahártyákat, a szemet és a légutakat, és szabad halogének rendelkeznek továbbá fojtó hatása. Különösen veszélyes a fluor és a hidrogén-fluorid, amely képes korrodálódnak a bőr és csont.
A klór elektrolízissel előállított vizes oldatainak NaCl (sóoldatokban) egyidejűleg képződnek, amikor a hidrogén és alkáli elektrolit:
Na + + HO- → NaOH
A kapott klórgáz, hogy koncentrációja ≈ 92% CI 2 és szennyezéseket tartalmaz N 2 O 2 és CO. Ezek elválaszthatók cseppfolyósítására a klór, amelyek párolgási a tiszta terméket kapjuk gyakran előnyösebb klórozási folyamatokban.
Hidrogén-klorid képződik a magas hőmérsékletű szintézissel hidrogén és a klór:
H 2 + Cl 2 → 2 HCI
Fluorid elektrolízissel előállított kálium-hidrogén-difluorid és olvadék KHF 2. vízmentes hidrogén-fluoridot - fellépés kénsav on folypátot:
CaF2 + H2SO4 → CaSO 4 + 2HF
Minden halogénezőszereket agresszív felé anyag gépek, és azok korróziós hatás, különösen megnövekedett jelenlétében még nyomnyi nedvességet. Ezért eljárásokat a fluorozási a gyártó berendezések használt réz vagy nikkel, és a klórozási vagy brómozási védik a acél test zománcok, ólom vagy kerámiai anyagok, továbbá speciális típusú acél, grafit, és felvert csövekhez - ólom. Korróziójának csökkentésére nemcsak halogénező képességük, szerves reagensek kell alávetni kiszáradás.
2. Biztonság hasonló eljárásnak
Amellett, hogy az általános kapcsolatos kérdések robbanásveszélyességéről és a toxicitás a kiindulási anyagok (szénhidrogének, szén-monoxid), halogénezés fordul elő számos konkrét biztonsági feltételek.
Nem csak halogénezőszereket, hanem arra is, hogy a halo-származékok gyakran fokozott toxicitást. Ezek befolyásolják a központi idegrendszert, gátló- vagy narkotikus hatás (kloroform, klorál), irritálják a nyálkahártyákat, a szemet és a légutakat (benzil, klór-aceton) és a foszgén fojtó hatása. Ennek eredményeként, a halogénezési növekszik követelmények feszességét és szellőztető berendezés található. A munkahelyen szükséges elsősegély felszerelés és gázálarc.
Szabad halogének, mint az oxigén és a levegő, lehet olyan szénhidrogén és a szén-monoxid robbanásveszélyes keverékek. Az égési folyamat légkörben halogénatom nagyon exoterm, és bizonyos koncentrációkban továbblép robbanás. Az alsó és a felső határértékek robbanó keveréket az alacsonyabb paraffinok és olefinek klórral közötti tartományban 5-60% (térf.) Szénhidrogén. Ez szükségessé teszi, hogy különleges biztonsági intézkedéseket, ha összekeverjük a szénhidrogén halogének, különösen a magas hőmérsékletű gáz reakciókat. De a robbanékonyság ilyen produkciókat tovább fokozza az a tény, hogy sok halogénezett így levegővel robbanó elegyet. Így a robbanási határok keverékek levegővel fel (térf.):
CH3 CI - 7,6 ÷ 19,0
C 2 H 5 Cl - 3,8 ÷ 15,4
C 2 H 4 Cl 2-6,2 ÷ 16,0
Számának növelésével a halogénatomok a molekulában a vegyület robbanás csökken, és még a metán-tetrakloridot használt tűzoltásra.
3. Eljárás Kémia és Technológia
Oxiklórozó HCI és hasítást a különböző reaktorokban. De amikor a hőmérséklet eléri a 400 - 4500S lehetséges, hogy összekapcsolják a két folyamat, és több mint ellensúlyozza a költségek hő felosztása. Ennek alapja az egyik leghatékonyabb módszer a jelenleg termelnek három - és a tetraklór-etilén - a 1,2-diklór-etán vagy egyéb klórozott C 2.
2CH2CI-CH2CI + CI2 + 1,5O2 → 2CHCI = CCI2 + 3H2O
2CH2CI-CH2CI + 2CI2 + 2O2 → 2CCI2 = CCI2 + 4H2O
Összehasonlítva egy kombinált klórozás és dehidroklórozásán 1,2-diklór-etán, hogy kedvezően minimális fogyasztás a klórt és a hiánya kialakulásának melléktermék HCI. Nyilvánvaló, hogy ez a folyamat, attól függően, hogy az arány a klór és 1,2-diklór-etán, a keverék Klór, és az elégtelen prohlorirovannye anyagokat visszavezetjük a reakcióba. Az eljárás lehet küldeni átvételekor három közös - és a tetraklór-etilén segítségével a nyersanyagok nem csak 1,2-diklór-etán, de a különböző hulladékok klórozott C 2. Az eljárást végzik fluidizált katalizátor, eltávolítja a felesleges hőt forrásban levő vizes kondenzátum és a gőz generáló nagy nyomást. Az iparban, vannak nagy teljesítményű létesítmény koprodukciója három - és tetraklór ezzel a módszerrel. Ha etán általában szükségtelenné teszi a külső klór:
CHCI2-CHCI2 + 0,5O2 → CCI2 = CCI2 + H2O
Annak érdekében, hogy tovább csökkentse a költségeit klórozott C 2. használják nyersanyagként vagy keverék az etán és etilén. Így, a folyamat az érdeklődés „Transkat”, ahol a reakciót végezzük a keringő olvadék oxiklórozási katalizátor elválasztása a klórozás és oxidációs lépések. Ő nem alakulhatott ki, mert a nehézkes keringés a nagy olvadék tömegek. Egyéb módszerek alapján a kombinációt vagy a kombináció a közvetlen és oxidatív klórozás megszüntetése sósavval és más reakciók. Így az egyik a folyamatok megvalósított az iparban (ábra. 1) az 1 reaktorban egyesítjük közvetlen klórozása etán (vagy elegyeinek etilénnel) és hasítása a klórozott HCI. A 2 rendszerben az első szakaszban terméket izoláljuk cél chloroolefins (vinil-klorid vinildenhlorid), és a maradék anyagok, beleértve az etilén, átalakítatlan etánt, és a HCI. Fed 3 reaktorban a oxiklórozási. Ott etán kapott, amely elkülönül a levegő és visszavezetjük a reaktorba 1. A folyamat egyesítjük az hidroklórozása vinilidén-klorid gyártására kloroform és oxidatív klórozása nem célzott szerves klórtartalmú anyagok három - és a tetraklór-etilén.
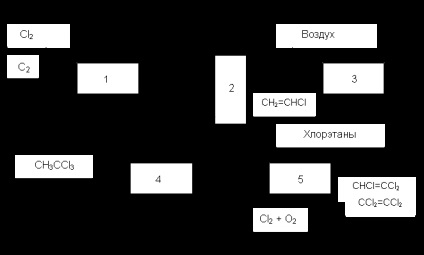

Ábra. 1 tömbvázlata kombinált feldolgozása etán vagy ezek keverékei etilénnel
1. Thermal klórozás és dehidrokiórozó, 2. helyesbítése, 3. oxidatív klórozás hidroklórozása 4., 5. Az oxidatív klórozás és dehidrokiórozó
Ennek megfelelően, az ipari folyamatok, kombinált és kombinált klórozott hasítás és az oxidatív klórozás mély hatással a fúziós technológia legtöbb mnogotonazhnyh szerves klórtartalmú termékeket, a gazdasági hatékonyság e növények és a környezet. Ez megerősített kidolgozása és végrehajtása ezeket a folyamatokat, amelyek fokozatosan felváltja régebbi és kevésbé hatékony termelést.
2. Chichibabin elején szerves kémia. Goskhimizdat M., 1963. - 922 p.;
3. Lebegyev és Technológiai alapvető szerves és petrolkémiai szintézis. M. Chemistry. 1988. - 592 p.;
4. Vishnjakova petrolkémiai szintézis. M., 1973. - 448 p.;
5. Yukelson bázikus szerves szintézissel. M. "Chemistry" 1968.