A vízmolekula szerkezete - a víz mint fizikai test struktúrája
Az összes szokásos folyékony víz - legsokoldalúbb folyékony oldószer maximális értékei a felületi feszültség, dielektromos állandó, és a magas hő párologtatás (miután ammónia) fúziós hője. A legtöbb anyagtól eltérően a víz kis nyomáson fagyasztva bővül.
A víz sajátos tulajdonságai a molekula speciális szerkezetéhez kötődnek. A H2O víz kémiai képletje megtévesztően egyszerű. Egy vízmolekulában a hidrogénatomok magjai aszimmetrikusan helyezkednek el az oxigénatom és az elektronok magjához viszonyítva. Ha az oxigénatom a tetraéder közepén helyezkedik el, akkor a két hidrogénatom tömegközéppontjai a tetraéder sarkainál fognak elhelyezkedni, és a két pár elektron töltéseinek központjai a másik két szöget foglalják el (1.1. Így négy elektron helyezkedik el a lehető legnagyobb távolságra mind az oxigén atom magjától, mind a hidrogénatomok magjától, ahol az oxigénatom magját még mindig vonzzák. A vízmolekula másik hat elektronja így rendeződik: négy elektron olyan helyzetben van, hogy kémiai kötést biztosít az oxigén és a hidrogén atomok között, míg a másik kettő az oxigénatom magjához közel helyezkedik el.
A vízmolekula atomjainak aszimmetrikus elrendezése az elektromos töltések egyenetlen eloszlását okozza, ami a vízmolekulát polárisvá teszi. A vízmolekula szerkezete a vízmolekulák vonzását okozza egymás között a köztük lévő hidrogénkötések kialakulása következtében. A hidrogén és oxigénatomok elrendezése a vízmolekulák képződött aggregátumaiban hasonló a szilícium és oxigén atomok elrendezéséhez a kvarcban. Ez a jégre és kisebb mértékben a folyékony vízre vonatkozik, amelynek molekuláinak aggregátuma mindig az újraelosztási szakaszban van. Amikor a víz lehűl, molekuláit aggregátumokká csoportosítják, amelyek fokozatosan nőnek és stabilabbá válnak, amikor megközelítik a 4 ° C-os hőmérsékletet, amikor a víz eléri a maximális sűrűséget. Ezen a hőmérsékleten a víz még nem rendelkezik merev szerkezettel, és hosszú molekulák láncolataival együtt nagy számú egyedi vízmolekulát tartalmaz. További hűtéssel a vízmolekulák láncai növekszenek, mivel szabad molekulákat adnak hozzájuk, aminek következtében a víz sűrűsége csökken. Amikor a víz jéggé változik, minden molekulája többé vagy kevésbé merev struktúrává válik kristályokat képező, nem zárt láncok formájában.
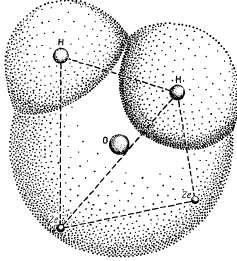
Hidrogén és oxigénatom kölcsönhatása. Két hidrogénatom és két pár elektron magjai a tetraéder sarkaiban helyezkednek el: az oxigénatom magja a központban helyezkedik el.
Nagy értékű felületi feszültség és hő párologtatás vizet annak a ténynek köszönhető, hogy a víz molekulákat elválasztjuk a csoport molekulák igényel egy viszonylag nagy energiaráfordítás. A vágy a vízmolekulák a hidrogénkötést létesítsen és polaritás magyarázza a szokatlanul nagy vízoldhatóságú. Egyes vegyületek, például cukrok és alkoholok, a hidrogénkötések következtében oldatban maradnak. A vegyületek, amelyek a magas fokú ionizációs a bemeneti, mint például a nátrium-klorid, megmaradnak az oldatban annak a ténynek köszönhető, hogy az ionok semlegesítjük ellentétesen töltött csoportok orientált vízmolekulák.
A H2O vízmolekulát háromszög alakjában állítják elő: a két oxigén-hidrogén kötés szöge 104 fok. De mivel mindkét hidrogénatom az oxigén egyik oldalán helyezkedik el, az elektromos töltések diszpergálódnak. A vízmolekula poláris, ami oka a különféle molekulák közötti speciális kölcsönhatásnak.
A H2O molekulában a pozitív részleges töltéssel rendelkező hidrogénatomok kölcsönhatásba lépnek a szomszédos molekulák oxigénatomjainak elektronjaival. Az ilyen kémiai kötést hidrogénkötésnek nevezik. A H2O molekulákat a térszerkezet sajátos polimereibe egyesíti; sík, amelyben a hidrogén-kötések vannak elrendezve síkjára merőleges atomok ugyanabban a molekulában H2 O. közötti kölcsönhatás vízmolekulák és magyarázható elsősorban szabálytalanul magas olvadáspontú és annak forráspontja. Szükséges további energiát hozni a rázáshoz, majd elpusztítani a hidrogénkötéseket. És ez az energia nagyon fontos. Ezért van a víz hőteljesítménye olyan nagy.
A legtöbb anyaghoz hasonlóan a víz molekulákból és az utolsó atomokból áll.
Az atom szerkezete a következő: a pozitív töltésű protonmag körül a különböző pályák mentén különböző szinteken a negatív töltésű elektronok, amelyek az elektronfelhő alakulnak. Az egyes elemek atomjának minden egyes héjában lévő elektronok számát szigorúan meg kell határozni. Tehát a hidrogénatomnak egyetlen elektronhéja van, és az oxigén atom két héjjal rendelkezik: egy belső, két elektron és egy külső hat.
Két hidrogénatom van helyettesítve két pozícióban hiányzik (legfeljebb nyolc) a külső héj elektronok annak stabilitását. Az ember azt feltételezi, hogy az oxigénatom és a két hidrogénatom egy molekula víz formájában a központi oxigénatom egy szög közel 180 °. A valóságban azonban ez sokkal kisebb - csak 104 ° 27 „(1.2 ábra), ami a hiányos kompenzáció intramolekuláris erők, ami aszimmetria feleslegben töltéseloszlás amely megteremti a polaritását vízmolekulák. Ez polaritása vizet, még jelentősebb, mint más anyagok hatására a dipólmomentum és dielektromos állandó. Az utóbbi a víz közelében nagyon nagy, és meghatározza a különböző anyagok vízoldódásának intenzitását. 0 ° C-on a víz dielektromos állandója (szilárd fázisban) 74,6; a hőmérséklet emelkedése csökken.
Így 20 ° C-on a víz dielektromos állandója 81. Mit jelent ez? Ez azt jelenti, hogy két egymással ellentétes elektromos töltés a vízben kölcsönösen vonzza az egyenlő erőt
1/80-at a levegőben, és hogy az ionok elválasztása a sók kristályaitól vízben 80-szor könnyebb, mint a levegőben.
Számos áramköri szerkezet a vízmolekulák hipotetikus épített közvetett megfigyelések eszközök jeleit viselkedését és jellemzőit a molekulák és atomok. Nem szabad elfelejteni, hogy nem atomok vagy molekulák nincs egyértelmű határokat, mivel a bizonytalanság a formai és pontos méretei a pályák, amelyben elektronok, alkotó tulajdonképpen az elektron felhő, attól függően, hogy az energia állapot egy elektron. Ez utóbbi lehet nyugodt vagy izgatott, ami elsősorban a hőmérsékleten múlik. Ezért ellentmondás a számított értékei sugarak, valamint a sematikus hipotetikus modelleket az atomok és molekulák.