Geometriai ks szerkezetének és a típus a hibridizációs
Miután meghatároztuk az párosítatlan elektronok a COP, megtudja az oxidáció mértékét a komplexképző hibridizációs annak típusát pályák, és következésképpen, a térszerkezet.
Reaktivitása a COP miatt hibridizációs bevonásával külső d-pályák és a jelenléte komplexképző szabad „belső» d-pályák. COP külső hibridizáció - sp 3 d 2 reakcióképesebb, mint a COP belső hibridizáció - d SP 2 3 (például [Fe (H2 O) 6] 2+ és [Fe (CN) 6)] 4-).
Az energia eloszlása d - AO befolyásolja komplex stabilitása: a legstabilabb (ceteris paribus) komplexeket kitöltött és félig töltött sublevels.
Így a TAP magyarázza sok tulajdonságait komplexek társított a töltelék a elektronok „belső” d - AO: a stabilitás, a reakcióhőt, a mágneses tulajdonságok; ő sikeresen megjósolta spektrum (szín) rendszereket.
A TAP az a hátránya, hogy figyelembe veszi a szegény fő szerepet az energetikai kötéseket, jellemzően egy donor-akceptor jellegű. Ezért, egyidejű használatát két elmélet - FA és a TAP - adnak kiegészítő információkat.
Molekulapálya elmélet (TMT) lehetővé teszi, hogy gazdagabb információt a szerkezete és tulajdonságai komplexek (ami különösen magyarázza spekrtrokémiai sorozat, amely nem TAP). Azonban a TMO jobban megfelel a magas minőségű leírások és értékelések.
Így, fokális nevezett kémiai vegyületek különböző típusú és állapotait aggregáció stabil koordináló ligandumok körül a központi atom vagy ion, van kialakítva egy egyszerű kiindulási struktúrákat a lehetséges mechanizmusok azok kölcsönhatása.
Komplexképzését kiterjeszti a lehetséges tartománya a vegyérték kapcsolatok száma következtében nő bevonásával számos elektronok és töltetlen pályák.
7.2. Ellenőrző kérdések és feladatok
1. Összetétel KC: a komplex ion, a központi atom, ligandumok, a koordinációs száma semleges atom. A belső és a külső gömb COP.
2. Az oxidáció mértéke a komplexképző és komplex töltés IRA. Nómenklatúra COP. Név: a) K [AuBr4], b) Na3 [Ag (S2 O3) 2] a) [Cr (H 2O) (NH3) 4 Br] Cl2. Határozza ott külső és belső egyeztetni komplexképző szer, annak oxidációs állapotát, a felelős a komplex ion, a ligandumok.
3. Írja a szerkezeti képletét CS: tetraamminomedi-nitrát (II), dibromotetraamminoplatiny-klorid (IV), amminopentahloroplatinat (IV) kálium-tetratsianotsinkat (II) tetraamminomedi (II), trihlorotriamminokobalt. Milyen az egyes komplexek?
4. Tegyünk fokális következő általános képletű vegyületek: a) 3NaF · AIF3. b) NH4 Br · CuBr2 · 2NH3. a) CoCl2 · 4NH3 · H2 O, Z) 2ba (OH) 2 · Cu (OH) 2.
6. Milyen típusú hibridizáció esetében megfigyelt kialakulásának CS? Adjon példát.
7. A konstans instabilitás és stabilitási állandója COP. Módszerek COP megsemmisítése.
8. A CS az orvostudomány és gyógyszerészet.
Példák problémák megoldása
1. példa Határozzuk meg a komplex töltését ion koordinációs száma (CN), és az oxidáció mértékét a komplexképző vegyületek: a) K4 [Fe (CN) 6]; b) Na [Ag (NO 2) 2]. Bemutatott vegyület neve.
Határozat. A komplex töltésétől ion egyenlő, hogy a külső gömb, de ellentétes előjelű. A koordinációs szám a ligandumok száma. Az oxidáció mértéke határozza meg komplexbe ugyanaz, mint az oxidációs állapotban egy atom bármely vegyületet.
2. példa Írja expresszióját az instabilitás állandó komplexet [Fe (CN) 6] 4-.
Határozat. Komplex sót hogy az erős elektrolit vizes oldatban disszociál ionokra visszafordíthatatlanul külső és belső gömbök:
Komplex ion reverzibilisen disszociál, és kisebb mértékben:
Ezt a folyamatot az jellemzi, instabilitása állandó a komplex:
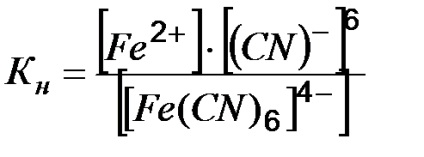
A kevésbé KH. A tartósabb a komplexum.
7.4. egyéni feladatok
Feladat 1. Oldja meg a problémát a variáns (fülre. 47).
Options ellenőrzési feladat