Szorpciós - ez
Szorpciós (lat sorbeo -. Elnyel) - a felszívódását a szilárd test, vagy a környező folyékony közeg különböző anyagok. Elnyelt anyag a környezetben, az úgynevezett szorbát (sorbtivom), abszorbens szilárd test vagy folyékony - szorbens.
Természete által felszívódását szorbát szorpciós jelenségek két csoportba sorolhatjuk: adszorpciós - az oldott anyag koncentrációja a határfelületen, vagy annak abszorpciós felületi réteg és a szorbens abszorpciós - volumetrikus abszorpciós ahol az oldott anyag eloszlik a térfogata a szorbens.
Másfelől, kétféle adszorpció - fiziszorpció, amelynél megnövekedett az oldott anyag koncentrációja a határfelületen miatt nem specifikus (azaz, nem függ a az anyag természetétől) által van der Waals-erők és kémiai adszorpció (kemiszorpció) miatt kémiai reakciók szorbát szorbens felületre. Fizikai adszorpciós slabospetsifichna reverzibilis és annak termikus hatás kicsi (néhány kJ / mól). Kemiszorpciós szelektív, általában visszafordíthatatlan és annak hő a tíz több száz (oxigén kemiszorpció fémre) kJ / mól.
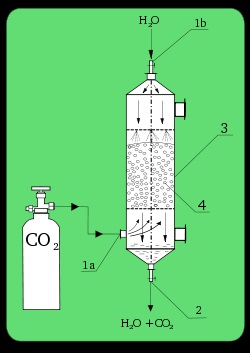
Laboratóriumi elnyelő. 1a). CO2 bemeneti; 1b): bemeneti H2 O; 2). kiadja; 3). abszorpciós oszlop; 4). töltőanyagot.
Felszívódás a kémia - fizikai vagy kémiai jelenség vagy folyamat. ahol atomok. molekulák vagy ionok lép kakoo egy volumetrikus állapot - gáz. folyékony vagy szilárd test. Ez a folyamat eltér az adszorpciós. mivel a molekulák áteső abszorpciós mászni mennyiség helyett a felületen (például abban az esetben az adszorpciós). Egy általánosabb kifejezés - szorpciós amely magában foglalja abszorpciós folyamatok, adszorpciós és ioncsere. Felszívódás, alapvetően - az a folyamat, amelyben valami egy újabb anyag. [1]
Ha felszívódás fizikai folyamat, nem kíséri más fizikai vagy kémiai eljárást, ez általában vonatkozik a törvény a Nernst-eloszlás:
„Abban egyensúlyi az arány a harmadik komponens koncentrációja a két folyékony Államokban állandó.”;
KN állandó térfogatú függ a hőmérséklettől és az úgynevezett megoszlási hányados. Ez az egyenlőség igaz, feltéve, hogy az összefonódás nem túl nagy, és ha a molekulák „x” nem változtatja meg az alakját bármely más, a két állam között. Ha ez a molekula van kitéve, asszociációs vagy disszociációs. akkor ez az egyenlet még mindig le, mint az egyensúlyt a „x” mindkét állam, de csak ugyanabban a formában - a koncentráció az összes megmaradt formáinak kell figyelembe véve számítják ki az összes többi egyensúlyok. [1]
Abban az esetben, a gáz-abszorpció segítségével számítható a koncentrációja az ilyen ideális gáztörvény. c = o / RT. Alternatív módon, egy tudja használni a parciális nyomása helyett a koncentráció.
Sok technológiai szempontból fontos folyamatokat, kémiai abszorpciós helyett használható egy fizikai folyamattal, például abszorpcióval szén-dioxid nátrium-hidroxiddal - ilyen folyamatok nem követik a Nernst szerinti eloszlás.
Néhány példa erre a hatást lehet tekinteni kitermelés. amelyben a komponens lehet távolítani az egyfázisú folyékony oldatot és át egy másik kémiai reakció nélküli. Ilyen megoldások - a nemes gázok és az ozmium-oxidot. [1]