Izotermák egy igazi gáz
Ahhoz, hogy tanulmányozzuk a viselkedését egy igazi gáz izotermák vizsgálni a van der Waals - görbék a megadott hőmérséklet, T egyenlettel határozzák meg a van der Waals-erők alkalmazzuk 1 mol gáz (9.2 ábra.). Ezeket a görbéket figyelembe négy különböző hőmérsékleten. Magas hőmérsékleten a izoterma egy igazi gáz eltér az ideális gáz izotermák csak némi torzulás alakja, tartózkodó monoton görbe. Egy bizonyos hőmérséklet a izoterma van egy inflexiós pont K. Ez az úgynevezett kritikus izotermát, a megfelelő hőmérséklet - a kritikus hőmérséklet. és a K pont - a kritikus pont. Az állam a kritikus paramétereket nevezzük kritikus állapotban van.
Hőmérsékleteken van hullámos része az izoterma. A valós izotermák a göndör nem, hanem van egy egyenes és vízszintes szakasz (ábra. 9.2 szaggatott vonal). Ha a végén pont a vízszintes szakaszok izotermák a család, hogy tartsa a vonalat, akkor kap egy haranggörbe határoló régióját kétfázisú halmazállapot. Ez a görbe, és a kritikus izoterm szakadék P chart, V alatt izoterma három régióra: a haranggörbe a régió két-fázisú körülmények között (folyékony és telített gőz F + P), hogy a bal oldalán van egy területe a folyékony állapotban (F), és a megfelelő - régiót pár ( P). Gőz különbözik a többi gáznemű kimondja, hogy izotermikus kompresszió megy végbe, cseppfolyósítási folyamatba. Gázkút a kritikus hőmérséklet felett nem lehet alakítani egy folyékony alatt nincs nyomás.
2. metastabil állapotok (Gk meta -. Után, az, ebben az esetben a stabil állapot, instabil állapotban).
Tekintsük a részét az izotermák látható. 9.3. Az állam a terület 2-3 nem hajtják végre, a rajta. azaz növeli a gáz térfogata lenne csatolni nem csökkent, és a nyomás nő - meglehetősen természetellenes tulajdon. Azokon a területeken, 1-2 és 3-4. ez normális, de kiderül, hogy ezek az államok nem teljesen stabil. Elegendő annak megállapítása, A porszemcsék belépő gőz anyagot szétesett két fázisra, és átvisszük egy állami B. (Emlékezzünk, hogy a fázis az úgynevezett homogén, azonos rendszer tulajdonságai. Például a víz egy zárt edényben, és az elegyet a levegő és a vízgőz. A gőz, vravnovesii található annak fluid nazyvaetsyanasyschennym.
A nyomás, amelyen egyensúlyi figyelhető nevezzük a telített gőz nyomása). Állami hasonló A (instabil) nevezzük metastabil. Feltétel 1-2, ahol a nyomás kisebb, egy adott hőmérsékleten az úgynevezett túlhevített folyadék. és 3-4
() - túltelített gőz. Tekintsük az állam túltelített gőz. A folyadék cseppecskék formálásának kell konvergencia molekulák a sorrendben közötti távolság a molekulák a folyadékban. Ez megköveteli a jelenlétét kondenzációs magvak (porrészecskék töltött részecskék, folyadékcseppek). A felhő kamra (angol tudós, 1927 Nobel.) Air vízgőzzel telített gyorsan tágul, és rendre, lehűtjük. Párok állapotban vannak a telítettség. Ha egy töltött részecske kerül a kamrába, a gőz kondenzálódik rajta kis cseppek, amely egy látható megjelölés ( „track”) a mozgása során.
Tekintsük a túlhevített folyadék. Ha a folyadék alaposan tisztítani a szilárd zárványok, majd melegítéssel vagy nyomás csökkentése előtt lehet lefordítani állapotban túlmelegedést. Passage töltött részecskék képződéséhez vezet részecskék a pálya mentén forró germinális központok. Bubbles fényképezett.
Nézzük meg az állami t. K (ábra. 9.2.). Ezen a ponton a különbség a sűrűség a folyadék és gőz teljesen eltűnik. Egyidejűleg eltűnik semmilyen különbséget folyadék és gőz. Az interfész közötti folyadék és gőz is nem. Az első és a második származékai a nyomás a volumen nulla.
3. A belső energia egy igazi gáz. Továbbá a kinetikus energia tartalmaz potenciális energia közötti kölcsönhatás gázmolekulák. A munka során a bővítés gáz ellen vonzó- a molekulák egymáshoz, egyenlő egy növekménye kölcsönhatási energia. Van der Waals-korrekció a nyomást. Aztán a munka. így a potenciális energia
Amikor egy valódi gáz elkötelezett az ideális, majd:
Korábban az a kinetikus energia a random hő a molekulák mozgása kapunk :.
A belső energia egy igazi gáz, figyelembe véve mind a kinetikus és potenciális energia:
Azaz a belső energiája mol Van der Vaal gáz függvénye a gáz halmazállapotban.
4. A fojtás
Joule - Thomson gáz hőmérséklete változik eredményeként az adiabatikus fojtás - lassú gázáram alatt állandó nyomáskülönbség szerte fojtás akadály (például egy porózus membrán Dr. - fojtó ábrán 9.4.). A „adiabatikus” kifejezés nélkül hőcsere a környezettel. Adiabatikus végezhetjük például egy hőszigetelő héj körül a csatorna. a
hogy a dugattyút (P) képez állandó nyomáskülönbséget (). Megkülönböztetni a) pozitív hatást T. reális gáz, ha a hőmérséklet csökken, és a b) negatív hatást. ha (ideális gáz T = const). A gyakorlati haszna van pozitív hatása. A pozitív hatás volt megfigyelhető a nyomás dominált silyprityazheniya
a molekulák között. Amikor bővülő gázmolekulák nem dolgozik erői ellen a vonzás és a hőmérséklet csökken. A mozgási energia termikus mozgás a gáz fogyasztott a művelet erői ellen a molekuláris vonzási.
A hőmérséklet változás jelentős lehet. Például, a levegő kitágul szobahőmérsékleten, a nyomás a 200 ATM-1 atm nyomás lehűtjük körülbelül 40.
Az alkalmazott eljárás a szakterületen a gázok cseppfolyósítását. A hatás a Joule - Thomson munkájának alapja az úgynevezett Linde gépek.
Gáz cseppfolyósítása és alacsony hőmérséklet szerezni
A gáz lehet alakítani folyékony állapotban, ha a hőmérséklete a kritikus hőmérséklet alatt, és forráspont alatti egy adott nyomáson.
Linda gép (német tudós) (ábra. 9.5)
A légköri levegőt sűrített egy kompresszor (K), hogy a nyomás 220 atm. Sűrített levegő vezetéken át folyó vízzel, és lehűtjük 10, 15-én. Ezután a levegő belép a belső csatorna
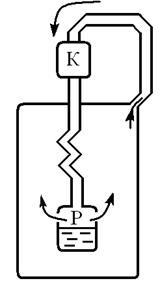
tekercsnek a tartályból (R), ahol a nyomás a 20 atm. Amikor ezt a levegőt lehűtjük 50 (Expansion történik a pozitív Joule-hatás - Thomson) .. A hűtött levegő a külső tekercs csatornát rendelt a kompresszor, hűtés ezen részei a levegő, elérve a belső csatorna, stb A hőmérséklet 180 és a nyomás a 20 atm. Air kondenzációs kezdődik. Folyékony levegő áramlik a tartályba.
Hűtőturbina Kapitza (orosz tudós és Nobel-díjas, 1894-1984). Gáz kompresszor által (C), hogy a nyomás 6-7 atm táplálunk a turbina (T), bővül nyomáson 1,3 atm. végez munkát, lehűtjük, tovább hűti a gázt a kompresszorba belépő cirkulál, stb és végül kondenzálódik. Ez a módszer is megkapják a folyékony nitrogén, oxigén, hidrogén, hélium. (Megjegyezzük, hogy a folyékony oxigén forráspontja 90 K, 78 K nitrogént, hidrogént, 20K, 4.2K hélium). Folyékony gázok használják az iparban, az orvostudomány és a légi közlekedés.