töltési pályák
Amikor kitölti az elektronok atomi pályák az alábbi három szabály:
1. A fenntarthatóság elve (a minimális energia elve). Pályák vannak kitöltve kiindulva, amelynek a legalacsonyabb energiájú és továbbá az eljárás az annak növekedését. Ebben az esetben az energia az atom a minimális, és a stabilitás - maximális.
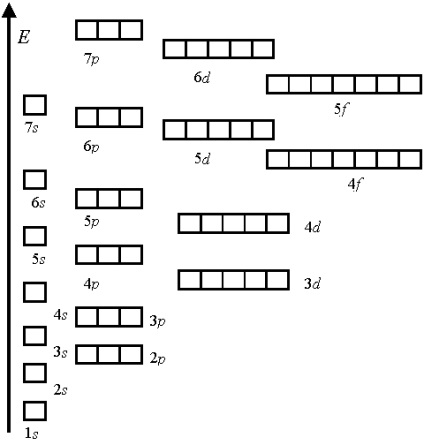
Energia-szekvencia könnyen leírható összeget szabályt az első két kvantum szám n + l. Ez a szabály az úgynevezett Klechkovskii szabályzat (1951):
Amikor kitöltése az orbitális héjak atom közül előnyös (több energetikailag kedvező), és így tölteni, mielőtt azon államok számára, amelyek összege a főkvantumszám n, és egy oldalsó (orbitális) kvantum szám l, azaz a n + l, van egy minimális értéke.
Például, az orbitális 4s. amelyekben n + l = 4 + 0 = 4, tölteni, mielőtt orbitális 3d. mimellett n + l = 3 + 2 = 5.
Amikor azonos mennyiségű energia alatt orbitális alacsonyabb fő kantovye számát. Tehát, 3d orbitális alacsonyabb energiát, mint a 4p.
A szokásos eljárás töltéséhez atomi pályák:
1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <4f =5d <6p <7s <5f=6d …
Száma pályák minden elektronikus szinten.
2. A Pauli-elv. Wat nem lehet két elektron, amelynek kvantumszámok mind a négy egyenlő lenne.
Mindenesetre pályák nem lehet több, mint két elektront és csak akkor, ha azok ellentétes forgás irányban. Ezek az elektronok hívják párosítva.
3. Hund szabály (1925). Atom az alapállapotú kell egy lehetséges legnagyobb számú páratlan elektronnal egy bizonyos réteget.
Kitöltése az energia nitrogén pályák: a - korrekt rendszer, b - rossz rendszer.