A képlet az etén kémia
Etén (etilén), - telítetlen szénhidrogén, osztályába tartozó alkének és mivel az őse a homológ sor. A szénatomok ez a vegyület vannak hibridizáció.
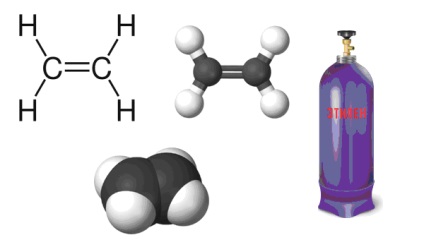
Móltömege g / mol.
Fizikai tulajdonságok - gáznemű anyag vízben oldhatatlan.
Etilén nagyszabású mennyiségű gázt kinyert repedés és kokszoló.
Kémiai tulajdonságok etilén
- Hála a kettős kötés az etilén jellemzi addíciós reakcióval. A hidrogénezés fordul elő a katalizátor jelenlétében (Pd, Pt, Ni):
kérelem
Az etilén fontos nyersanyag előállítására polimerek, nevezetesen, mint például polietilén, polivinil-klorid.
Ebből a kereskedelemben elő etanollal, fagyásgátlókat, ecetsav.
Példák problémák megoldása
Etanol úgy állíthatjuk elő, hogy az etilént és a vízgőz. Határozza termikus hatása ezt a folyamatot, és rögzíti a termokémiai egyenlet.
Írunk termokémiai egyenlet a reakcióhoz etilén hidratálása közben:
Kiszámításához a hőt a kémiai reakciók használjuk az első következménye a törvény Hess:
A standard képződési entalpia anyagok vesszük a könyvtárban:
.
Behelyettesítve a kapott értékeket a képlet a hő:
Ennek alapján a kiszámított értékeket írási teljes termokémiai reakció egyenlet forrás:
A kapott l g etanolt. Mi az elméleti hozam ebben az esetben? Határozzuk meg az elméleti mennyiségű termék.
Az kémiai reakció hozamát terméket értjük az arány a kapott anyag a kísérlet során, hogy a mennyiség elméletileg számított alapján a reakció egyenlet:
Az egyenlet a reakció az etilén révén kiszáradás etanol kapjuk:
Definiáljuk az etanol mennyisége anyagok aránya a tömegét a moláris tömeg:
E szerint a gyakorlati probléma az etilén hozam egyenlő n-nel, majd
A kapott mól Mol
A kapott mól Mol
Alapján a talált anyag mennyiségét etilén találni az elméleti térfogat: