Kiszámítása az entalpia és a hőkapacitása - studopediya
Amint a fentiekből látható egyenletek, a termikus reaktor kell feltétlenül ismeri kiszámításakor entalpiája reakció entalpiája fázisátalakulás komponensek és a komponensek hőkapacitás.
Ha nincs tábla értéke, entalpiája reakció lehet meghatározni
szakadék standard képződéshő és égési komponenseket a
felelős a törvény a Hess. a reakcióhoz
aA + BBe = RR + SS + # 8710; Hr,
standard reakcióentalpia számított képződéshő egyenlő
Ennek megfelelően entalpiája égésű
Értékei a standard képződéshő és égési megtalálható kézikönyvekben a fizikai és kémiai mennyiségek. Az érték a entalpiája reakció reakció-hőmérsékletre egyenlet által definiált
ahol CPI - i-moláris fajhője, hogy komponens; T0 - a "standard" hőmérséklet; T - tervezési hőmérséklete.
összetevői a entalpia alkalmazásával lehet számítani a entalpiája fázisátalakulások
mozog, és a hőmérséklet függvényében adott futamok fázisban. Feltéve munka referencia szint Tc általános képlet ebben az esetben lesz a forma
Index „mp” kifejezés olvadási entalpia és hőmérséklet „fűtött” -, hogy a forráspont és entalpia; „M”, „w” és a „Z” -, illetve, hogy a szilárd, folyadék és gáz. A hőmérséklet függése a hőkapacitása sok anyag megtalálható a referenciák fizikai és kémiai mennyiségek, amelyben az alábbi:
Ha ez a hőmérséklet-tartomány nem a fenti egyenletek együtthatók, lehetséges, hogy egy átlagos értéke fajhő nyert táblázatok vagy számítva empirikus összefüggések.
Empirikus összefüggéseket kiszámításának hőkapacitás fázis halmazállapot. Mivel a hőkapacitása mol fémek és egyéb kristályos anyagok nagyjából kiszámítani a szabály Dulong és Petit, ami arra utal, hogy minden egyes atom hozzájárul vegyületet molekula aránya a specifikus hő mintegy 26 J / (mol # 8729; K). Ezért a fajhője számítást el lehet végezni általános képletű vegyületet
ahol n - az atomok száma a molekulában; M - molekulatömegű vegyületek kg / mol.
Hőkapacitása sok szilárd anyag - egy adalékanyag mennyisége és megközelítőleg megegyezik az összeg az atomi hőt (általában Kopp):
,
ahol ni - az atomok számát egy adott típusú; Ci - Atomic hő, választható a táblázat. 9.7.
Táblázat 9.7. Az atomi összetevői a szilárd anyagok a fajhő
Ott CV és CP - fajhő állandó térfogaton és állandó nyomáson, illetve, és R - egyetemes gázállandó; R = 8314 J / (mol # 8729; K).
Indikatív értékét fajhője J / (kg # 8729; K) lehet beszerezni a következő képletek:
ahol n - az atomok száma egy molekulában a gáz vagy gőz; M - molekuláris tömege kg / mol.
A függőség a fajhője gázok és gőz keverék által nyomás és a hőmérséklet körülbelül formula határozza meg
ahol Cp - hő atmoszferikus nyomáson, J / (mol # 8729; C);
π - csökkentett túl magas gáznyomást, π = P / PCR; P - a felesleges gáz nyomása Pa; PCR - kritikus gáznyomás Pa; # 964; - gáz felületi hőmérséklete,
# 964; = T / Ta; T - a gáz hőmérséklete, K; TCR - a kritikus hőmérséklet a gáz.
A hőkapacitása a gáz és a gáz-gőz keverék körülbelül meghatározhatjuk az expressziós
ahol xi - mol vagy térfogathányada egy komponens a keverékben.
Példa 9.7. Annak megállapításához, a fajhője nitrogén hőmérsékleten 50 ° C, és az abszolút
névleges nyomás 20 MPa.
Megoldás: A szakirodalom szerint a nitrogén kritikus hőmérséklet 125,9 K, a kritikus nyomás - 3285 MPa, molekulatömeg - 0,028 kg / mol. Definiáljuk a izobár fajhője a normál hőmérsékleten és atmoszférikus nyomáson
CP = 1 = 3,5 # 8729; 8,314 = 29,1 J / (mol K).
# 964; = T / Ta = (273 + 50) / 125,9 = 2,566
A fenti túlnyomás
CP = 29,1 + (2.531 # 8729, # 8729 8,314; 5,783) / 2,566 = 36,6
Vagy fajhő
A fajhője a túlnyomó többsége a folyadékok közötti tartományban van 1600 - 2400 J / (mol # 8729 K), a legtöbb szénhidrogének, ez a paraméter megközelítőleg egyenlő 2100 J / (mol # 8729; K).
Durva becslés moláris fajhője folyadékok hajthatjuk végre általában Kopp, amely alkalmazható egy 20 ° C-on:
ahol ni - az atomok számát egy adott típusú; Ci - Atomic hő, választható a táblázat. 9.9.
Moláris fajhője folyadékok 20 ° C-on lehet kiszámítani módszerével Johnson - Huang :,
ahol ai - csoport vagy atomi összetevők (lásd a táblázat 9.10 ..).
Táblázat 9.9. Az atomi komponensei folyékony hőkapacitás
9.8 példa Számítsuk ki a módszer Johnson - hőkapacitású Huang benzolt (C6 H6) 20 ° C-on
Megoldás: Benzol képviselhet hat csoport álló = CH-, akkor Cp = 6 # 8729; 22,6 = 135,6 J / (mol # 8729; K).
Kísérleti táblázat érték 136,2 J / (mol # 8729; K).
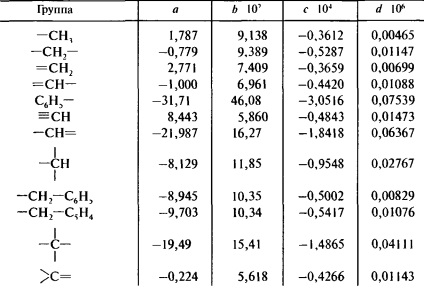
A második képlet Johnson - Huang lehetővé teszi, hogy megkapjuk a hőmérsékletfüggése fajhője
CP = A + BT + CT 2 + dT 3
Az együtthatók a, b, c és d táblázatban mutatjuk be. 9.11.
Egy fontos jellemzője a termikus reaktor lehet kiszámítani entalpiája a párolgás. Ebben az esetben, ha nem találja az asztalán érték, akkor lehet számítani. A legegyszerűbb, de nem teljesen pontos módszer általában Truton:
ahol Lisp.k - entalpiája elpárologtatási forrás hőmérsékleten J / mol; Tc - forráspont K
A pontosabb módszer Dzhiakolone:
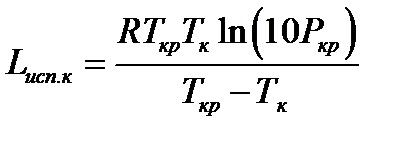
és ahol Tcr PCR - Kritikus hőmérséklet (K) és nyomás (MPa).
Táblázat 9.11. hőkapacitása számítási módszere Johnson-Huang
olvadási entalpia körülbelül meghatározhatjuk a következő képlettel
ahol LPL - olvadási entalpiája J / mol; Op - olvadáspontja K.
A szerves vegyületek közötti összefüggést olvadási entalpiája a párolgás és a forma