függelékben
Alapvető kémiai törvények [40]
A törvény megőrzése számít. Amikor az összes kémiai átalakulások vegyületek egymásba teljes tömegére mennyisége változatlan marad. Anyagok csak akkor változtatnak kémiai és fizikai tulajdonságait. Matter nem jön létre, és nem is megsemmisült.
A törvény az energiamegmaradás. Bármilyen okból, hogy képes előállítani a munka, az úgynevezett energia. Energia nem tűnik el, és nem jelenik meg magától. Minden esetben, a tünetek az ilyen típusú energia termelődik a egyenértékű (ekvivalens) s számos más faj. Amikor az exoterm reakciók a kémiai energia a reagensek teljesen vagy részlegesen átalakítható hőenergiává a endoterm reakciók, hogy azok hő fordított energia kívül.
Törvény állandó összetételű. Bizonyos kémiai vegyületek, a tömegaránya egységek folyamatosan.
A törvény több arányokat. Ha két test alkotnak maguk között több kapcsolat, akkor vesz egy több súlyt szervei állandó, azt találjuk, hogy a tömege körülbelül egy másik szerv lesz található közöttük egyszerű többszörös kapcsolatot.
Avogadro-törvény. Azonos térfogatú gázok mellett azonos fizikai körülmények között az azonos számú molekulát.
Avogadro-törvény - Gerard. A molekulák a vegyi anyagok a gáz vagy gőz állapotban, ugyanolyan fizikai körülmények foglalnak egyenlő térfogatú.
Törvény vegyértékű elemek. Vegyértékét (amelyet atomicitás, atomicitás) megvan az a képessége, hogy megtartja a atomja vagy helyettesítheti egy vagy több hidrogénatom, amelynek vegyértéke (egységek számát az affinitás) vesszük egységét.
Amikor összekötő elem egység affinitása az egyik ilyen telített egység affinitása egy másik elem. Például, az oxigén, amikor a kétértékű, össze van kötve két hidrogénatom.
Egyenértékű kg (egyenértékű) egy elem az úgynevezett súlya mennyiség, amely helyettesíti az egyik tömegegységére hidrogénatom. Az egyértékű elemek egyenértékű az atomsúly, a kétértékű - fele Általában, az egyenértékű a hányadosa a atomsúlya vegyérték.
Láttuk, hogy a kémiai elemek vannak osztva fémek és nem fémek. Egy éles különbséget ebben az esetben nem áll rendelkezésre. Így, az arzén és az antimon a tiszta fémek tulajdonságait a vegyületek - félfémet. Jód és brómatomot jellemző félfémek tiszta formában, amely képes bizonyos vegyületek tulajdonságait mutatják fémek; króm és mangán ugyanabban vegyületek, mint a tiszta formában, - hangsúlyos fémek, más - metalloidok.
Észrevehetően a szétválás elemek csoportba által hasonlósága tulajdonságaik.
Mengyelejev, feltételezve, hogy az egyes elemek tulajdonságait függ atomsúlyoktól besorolt összes ismert annak idején egyszerű anyag, forgalomba őket egy külön táblázatban. A modern, átdolgozott és bővített, hiszen látható a következő oldalon. Látható, hogy a tulajdonságai az elemek periodikus függősége atomsúlyaik. Mivel mennyiségi változások növekvő atomtömegük minőségi elemeket is.
„Sorokban, amelyen belül sorban történik változás a tulajdonságai elemek, Mendeleev úgynevezett időszakok két időszakban -. Lúggal fém lítiumot, galloida fluor és semleges argon gáz - 8 elemek Ez a kis időszakok A következő két - .. Big időszakok, a harmadik és a negyedik között egy alkálifém, és inert gáz, ez úgy van elrendezve, 18 elemeket a harmadik időszakban magas - 32 elem az elmúlt időszakban, hiányos, - 6 elemek.
„Big időszakok változnak kicsi, nem csak az a tény, hogy egyre több ilyen elem, hanem az a tény, hogy a legtöbb ilyen elem - a fémek és csak akkor jelennek meg a végén félfémet.
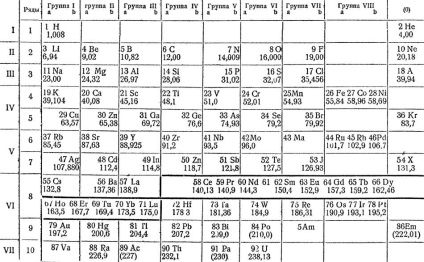
Periódusos rendszer elemeinek Mendeleev
„Big időszakokban, valamint a kicsik, kezdenek erőteljes fémek hasonló lítium és a nátrium, de aztán csökken fém tulajdonságokat és növelik metalloid lassú, és csak a legvégén van félfémek. Azonban van egy tulajdonság a hosszú időtartamot, amelyen keresztül minden egyes főbb korszakalkotó lehet két részre osztható megfelelő kis ideig. Ez a magasabb vegyértékű sóképző oxidok.
„Ha követjük a változás a vegyérték az elemek hosszú ideig tartó oxigénhiány, azt találjuk, hogy az első, ez vegyérték nőtt egy-hét, majd három nagyon hasonló egy másik eleméhez ugyanolyan vegyértékű - nyolc, majd a vegyérték esik egyet, majd ismét növekszik hét, és akkor nullára esik.
„Így, lehetőség van arra, hogy helyezze a alatti elemek nagy időszakok, amelyeknek megfelelő kis elemek vegyértéke időszakok, mint kapunk oszlopok elemek ugyanolyan vegyértékű.
„A táblázat 10 sor, az első sor csak két a legkönnyebb elemek - hidrogén és a hélium.
„Mielőtt az egyes elemek szimbólum készlet alak - a számozás az elemek milyen sorrendben követik egymást, -. Sorszáma nevek alatt a tételek kerülnek atomsúlyok.
„Elements táblázatos formában 9 oszlop vagy csoportok elemek ugyanolyan vegyértékű utolsó csoport -. Csoport inert gázok nem szándékozó rendelkező vegyület” nullavegyértékű „megjelölésen nulla - nulla csoport”.
„Abban az a táblázat alján a típusú megfelelő elemeit csoportok magasabb sóképző oxidok, vele helyett elemet tehetünk R betű jelet, nem jelképe a valamely elemet. A következő típusú magasabb gázhalmazállapotú hidrogén vegyületek ismert, csak a IV-VII csoportok. Amint ezekből jellemző képletek vegyértékét elemek hidrogénatom, növekvő atomsúlya, csökken a vízszintes sorokban. például klór-, heptád oxigént képez hidrogén-típusú vegyület RH, nevezetesen hidrogén-klorid. Ott klóratom egyvegyértékű. Meg kell jegyezni, hogy az összeg a vegyértékek az oxigén és a hidrogén állandó és egyenlő a 8”.
„Amikor Mengyelejev összeállította táblázata elemek periódusos vezetett a törvény, tudatában volt csak 64 elemből, míg most már tudjuk, a 92 elemet. Ezért sokan voltak üres helyek a periódusos rendszer, és az úton, ahol most áll az elemek Sc szkandium (4- st sorban III c.), Ga galliumot (5. sor III c.) és a germánium Ge (5. sor IV c.).
„Abban az időben, a megfelelő elemeket még nem voltak ismertek, és a többi elem közel atomi tömeg, nem tudta, hogy ezeket a helyeket, mert nem keresi meg őket a tulajdonságaik és kapcsolat típusát. Ennek alapján az időszakos törvény, Mendeleev 1871-ben fejezte ki meggyőződését, hogy ott kell lennie elemek, helyszínek, amelyek jelzik ezeket az időszakokat.
„Alapján pontos ismerete tulajdonságainak elrendezett mellett ezek a terek a vízszintes és függőleges irányban, Mendeleev már azonosított lehetséges értékeit atomsúlyainak elemet, és a tulajdonságokat, amelyeket meg ezeket az elemeket, maguk formájában egyszerű anyagok, milyen kapcsolatokat tudtak alkotnak, és milyen tulajdonságokkal ezek a vegyületek különbözőnek kell lennie. az előrejelzések a Mendeleev teljes pontossággal megerősítette. a hiányzó elemeket fedeztek élettartama során az időszakos „[41].
Mengyelejev jóslata a lehetőségét megnyitása új elemek tulajdonságai gyakran képest más tudományos „távérzékelés” - a csillagász Le Verrier a jóslat, hogy létezik egy ismeretlen bolygó a Naprendszerben. Valóban, egy ilyen nevű bolygó Neptunusz fedezték fel. Azt szokták mondani, hogy a Le Verrier felfedezett Neptune „hegyén tollát.” Az egyenlő joga mondható Mengyelejev, kinyitotta a toll minden előtte nem volt ismert elemeket.
A modern felfogás az anyag szerkezete
Mengyelejev szerint tudományos adatok idejével, hittek atom nem bomlanak le alkotórészeket, és amelynek állandó tömeg jellemző tulajdonságait az anyag a formát-egy adott kémiai elem.
A legújabb eredmények a fizika megmutatta a tévedés ezt a nézetet.
Atom nem a határ felosztása számít. Ez egy központi mag és a környező elektronokat. Készítmény atommagok viszont bonyolult. Ezek pozitív töltésű, és a környező külső elektronok - negatívan. A kémiai tulajdonságai az atom számától függ a külső elektronok, és atomsúlya - a protonok száma magok. A legújabb vizsgálatok kimutatták, hogy az atomtömege, például klór-, nem azért, mert egyenlő 35,456, hogy a klóratomot 35,456-szer nehezebb, mint egy hidrogénatom, és mivel a klór, bárhol is előállítható, mindig van egy keveréke atomok atomsúly 35 és 36-szor nagyobb, mint a atomsúlya hidrogén bizonyos kapcsolat egymással. Azok és mások is 17 külső elektronok, és mert a kémiai tulajdonságai, és nem térnek el egymástól. Az ilyen azonos atomok az elektronok száma, amelynek más az atomsúlya nevezzük izotópok (állva az ugyanazon a helyen a periódusos rendszer). Ezért az a következménye, hogy a tulajdonságai elemek függnek atomszámuk a periódusos rendszerben, míg őt a periodikus függőség, hogy már megadott Mengyelejev.
Legújabb eredmények a tudomány nem rázza meg a periodikus törvény a mi nagy vegyész, és kifinomult és fejlesztette.
Listát a leggyakrabban használt elemeket a szakterületen
Hidrogén (H). Hogy betöltse a ballon, a redukciós reakciók, az olaj repedés önmagában, azaz. E. Elkülönítve alacsony kazán lepárlási termékek, hidrogénezése szilárd tüzelőanyag ( „szintetikus olaj” a szén), hidrogénezése folyékony zsír szilárd.
Hélium (He). Ahhoz, hogy betöltse a léghajó (nem éghető!) És gazosvechnyh lámpák (piros fény behatol a ködben).
Argon (Ar), neon (Ne), és kripton (Kr). Mert glimmkisüléshez lámpák.
Szén (C). A szén - üzemanyagként; formájában grafit - tégelyeket, száraz kenőanyag, ceruzák, festékek; formájában gyémánt - vágás üveg, a fúrófejek, köszörülés. A számos vegyületet különféle alkalmazásokra. Például a vegyületeket hidrogén, mint a szén, gáz alakú és folyékony tüzelőanyagok.
Nitrogén (N). Gáz-kisülőlámpa, nitridálás acél ammónia szintézis és a nitrogéntartalmú vegyületek. Vegyületek: robbanásveszélyes anyagok, műtrágyák, színezékek, tápanyagok (úgynevezett fehérje).
Oxigén (O). Autogén hegesztés egy keverékben hidrogén és más éghető gázok, robbanásveszélyes oxyliquit keverve a szénpor, a légzés tengeralattjárók és gondolák sztratoszféra. A vegyületek fém - oxigén érc, festék, oxidok, különböző alkalmazások himproizvodstvah és a kohászat.
Szilícium (Si). Oxygen (szilícium-dioxid); kvarc üveg az építőiparban (homok), kerámia, üveg, vegyipari berendezések, villamosmérnöki (szigetelők) a cement, beton és így tovább.
Foszfor (P). Mérkőzések, műtrágyák, mérgező anyagok, a rézötvözet (foszfor bronz).
Arzén (As). Mérgek, festékek, gyógyszerek.
Az antimon (Sb). Ötvözetek, festékek.
Bizmut (Bi). Olvadó ötvözetek, festékek, gyógyszerek, kerámiák.
Kén (S). Kénsav, kén-színezékek, inzektotoksin (anyagok mérgező rovarok és kártevők általában).
A szelén (Se). A villamosmérnöki (megváltoztatja a vezetőképességét a megvilágítástól függően, így a korábban használt televíziók és hasonlók. F. Units).
A fluor (F). Üveg rézkarc, villamosmérnöki, kerámia, kohászat.
Klór (Cl). Fehérítés, fertőtlenítés, vegyi anyagok, festékek.
Brómatom (Br). Festékek, gyógyszerek.
Jód (I). Gyógyszerek, festékek.
Nátrium (Be) és a kálium (K). A napelemek, a sók formájában a himproizvodstvah, gyógyszer, műtrágyák (ammónium-nitrát).
Réz (Cu). Alkalmazásuk általában ismert vegyületek - színezékek.
Ezüst (Ag) és arany (Au). Az alkalmazás jól ismert az ízületek - a fotózás és üvegipar.
Magnézium (Mg). A megvilágítás, a vegyületek (magnezit) az építőiparban, az ötvözetek könnyűfémek.
Kalcium (Ca). Formájában mész és mészkő az építőiparban, a műtrágyák, a vegyipar és így tovább.
Bárium (Ba). Mentegetési.
Higany (Hg). Festék, gyógyszer, technológia.
Alumínium (Al). A tiszta formában adalékanyagaként acél és ötvözetek és repülőgépek mérnöki, víztisztítás vegyületek (alum) festésre, vegyi üzemekben, az olaj esetében és így tovább.
Ón (Sn). Poduda, forrasztás, olvasztható ötvözetek, kerámiák és vegyületek festésre (fehér).
Ólom (Pl). Víz, kémiai berendezések, tipográfiai és alacsony oivadáspontú ötvözet, a színanyagok (mínium színezésére fém cikkek, fehér).
Króm (Cr). Krómozás fémek gyártásához króm és rozsdamentes acél, a vegyületek, festés és oxidálószerként (krómsav-anhidrid) a himproizvodstvah.
Tungsten (W). Villamosmérnöki (izzólámpák), a kohászat számára szuperkemény ötvözetek.
Mangán (Mn). Adalék acél kölcsönöz rendkívüli tartósság, a vegyületek festés, mint fertőtlenítőszer.
Vas (Fe). Alkalmazás formájában vas (ötvözet vas, szenet és egyéb adalékanyagok), és a különböző minőségű acélból köztudomású a vegyületek festésre, mint inzektotoksin az orvostudományban.
Nikkel (Ni). A nikkelirovaniya az adalékanyag az acél, hogy növelje a viszkozitás, a vegyületek festés és a festékek gyártásához.
Kobalt (Co). Nemrégiben, a kobalt-borítás (bevonat más fémek a kobalt réteg) vegyületek - például festékek, a termelés speciális acélból.
Platina (Pt). Kémiai berendezések és üvegáruk, a villamos csatlakozások a fényképen. Platina-szivacs a himproizvodstvah abszorbens (megvastagodása gázok a felszínen) az anyag.
Megjegyzések:
A obschezhiteyskom, nem kifejezetten a kémiai értelemben.
Az arány Szervetlen Kémia V. Ipatiev és Sapozhnikova