A koncepció a kémiai reakciók és azok besorolása - kémia
1. A koncepció a kémiai reakciók
2. Besorolás kémiai reakciók különböző okokból
Listája használt irodalom
Anyagok kölcsönhatásban áll egymással, vannak kitéve különböző változások és átalakulások. Például, berillium kölcsönhatásban a légköri oxigénnel feletti hőmérsékleten 500 ° C-on alakítjuk berillium-oxid; széntüzelés, hogy szén-dioxid, stb
Jelenségek, amelyben bizonyos anyagokat átalakíthatjuk valamely más eltér az eredeti összetétele és tulajdonságai, és így nem változik a készítmény az atommagok, az úgynevezett vegyi.
Oxidáció a levegőn, égés, fémek előállítására ércek, rozsdásodó vas - az összes kémiai jelenségeket. Ellenkező esetben ezek az úgynevezett kémiai átalakítások, a kémiai reakciók és kémiai kölcsönhatások.
A cél ennek a munkának, hogy tanulmányozza a jellemzői a kémiai reakciók és azok besorolását.
A munka tartalmazza a bevezetést, két fejezetet, megkötése és az irodalomjegyzék. A teljes összeg a munka 17 oldalon.
1. A koncepció a kémiai reakciók
Kémiai tulajdonságait az azonosítjuk a különböző kémiai reakciók. átalakítása anyagok, kíséri változás azok összetételét és a (vagy) szerkezetét, és az úgynevezett kémiai reakciók.
Gyakran előfordul, és ilyen meghatározás: a kémiai reakció az átalakulási folyamat a kiindulási anyagokkal (reaktánsokkal) a végső vegyületet (termékeket).
Reagenty- szer belépő egy kémiai reakció.
Termékek- által előállított anyagok egy kémiai reakció.
Reagensek → Termékek
Fordította a latin „reakció” azt jelenti, „ellenállás, ellenállás, válasz.” Ennélfogva, a kifejezés kémiai reakció lehet értelmezni, mint egy elleni fellépése egy anyag hatására a külső anyagok és egyéb fizikai tényezők - hő, nyomás, sugárzás. De ez a meghatározás ősszel és fizikai folyamatok: olvadás, forrás, fagyasztás, és mások. Ezért kell tenni, hogy a kémiai reakció - ez a változata faj, amelyben a törött régi és az újabb közötti kémiai kötések részecskék (atomok, ionok) a amelyek beépített anyag.
„Hajtóereje” reakció nem csak attól függ a reagensek jellegétől és a kapott vegyületeket (azok összetétele, szerkezete), hanem az anyagok koncentrációjának, hőmérséklet, nyomás, oldószer hatása, vegyületek, amelyek képesek komplexet képezni a reagensek és a termékek.
Kémiai reakciók mindig kíséri a fizikai hatások - a felszívódását, illetve felszabadulását hő, változások az aggregált állapotban és színezőanyagokat; a jelenléte ezek a hatások gyakran ítélik meg a reakció (1. ábra).
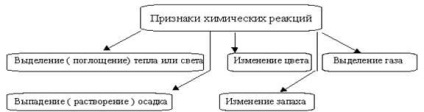
1. ábra - A tünetek a kémiai reakciók
Kémiai reakciók meg kell különböztetni a fizikai folyamatokat, amelyek módosítják csak a külső alakja vagy fizikai halmazállapot (de nem az összetétele). A feltételek, amelyeket teljesíteni kell, hogy egy kémiai reakció történt:
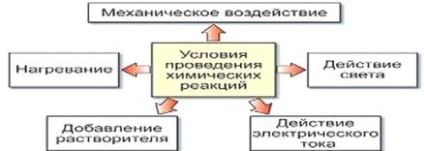
1. Szükséges, hogy a reaktánsok egymással érintkeznek, és a nagyobb érintkezési területen, a kémiai reakció fog bekövetkezni gyorsabb.
2. Egyes reakciók járjon melegítés nélkül, szükség van néhány, a reakciók.
3. Néhány a reakciók hatására elektromos áram és fény
Kémiai reakciók révén rögzített kémiai egyenletek. Formula tartalmazó kiindulási anyagok és a reakciótermékek, például:
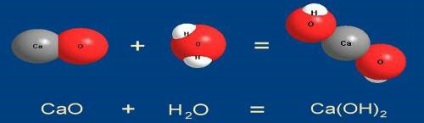
A + B = AB egy vegyület képződik több egyszerű vagy összetett anyagokat
AB = A + B A komplex termelt anyag több egyszerű vagy összetett anyagokat
A + BC = AC + B atomhoz egyszerű anyag helyettesíti az egyik atom egy komplex
AB + CD = AD + CB Komplex anyagok kicserélik alkatrészeik
1. reakciói vegyületek. Mengyelejev definiált vegyület, mint a reakció „, amelyben a két anyag fordul elő egy. Így, ha egy vegyület több reakció a reagensek viszonylag egyszerű kapott készítmény egy olyan anyagot, bonyolultabb összetételű kompozíciót
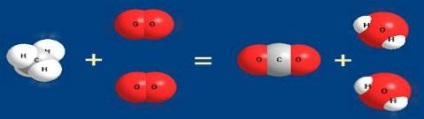
A képletű vegyületet, az égési folyamatok közé tartozik az egyszerű anyagok (kén, foszfor, szén) levegőben. Például, a szén-dioxid égési levegőben a C + O2 = CO2 (természetesen ez a reakció végbemegy fokozatosan, először képződő szén-monoxid CO). Jellemzően, ezek a reakciók kíséri hőtermelés, azaz képződéséhez vezet a stabilabb és kevésbé energiában gazdag vegyületek - exoterm.
Vegyületet egy egyszerű anyagok mindig redox jellegű. vegyület közötti reakciók komplex anyagok egyaránt előforduló változatlan vegyértéke
CaCO3 + CO2 + H2O = Ca (HCO3) 2
és légy a redox
2FeSl2 + Cl 2 = 2FeSl3.
2. reakciói bomlás. A kémiai reakciók a bomlás szerint Mendeleev, „az esetek, fordított kapcsolat, azaz azok, amelyekben egy anyagot biztosít két vagy, általában, egy adott számú anyagok - több közülük.
Bomlási reakciók kialakulását eredményezheti egy több vegyület komplex anyag
A lebomlási termékek vegyület egyaránt lehet egyszerű és összetett anyagok. Egy példa a bomlási reakció is szolgálhat kémiai bomlási reakció a kréta (mészkő vagy alatt hőmérséklet): CaCO3 = CaO + CO2. Foganatosítására bomlási reakció általában megköveteli fűtés. Az ilyen eljárások - endoterm, azaz a folytassa az abszorpciós hő. A bomlási reakciók, amelyek akkor jelentkeznek változás nélkül vegyértékű állapotban, meg kell jegyezni, bomlás kristályos, bázisok, savak és savas sói oxigénezett
CuSO4 5H2O = CuSO4 + 5H2O,
Cu (OH) 2 = CuO + H2O,
H2SiO3 = SiO2 + H2O.
A bomlási reakciói a redox karakter vonatkozik bomlás oxidok, savak és sók elemek a legmagasabb oxidációs
4HNO3 = 2H2O + 4NO2O + O2O,
2AgNO3 = 2Ag + 2NO2 + O2,
(NH4) 2Cr2O7 = Cr2O3 + N2 + 4H2O.
Különösen jellemző redox bomlási reakció a salétromsav sói.
bomlási reakciók a szerves kémiában, ellentétben a bomlási reakció a szervetlen kémiában, megvan a specificitása. Ezeket lehet tekinteni, mint a fordított folyamat a csatlakozás eredményeként az gyakran többszörös kötések vannak kiképezve, illetve ciklus.
A lebontási reakciót a szerves kémiában nevezik repedés
= + S18H38 S9H18 S9H20
vagy dehidrogénezési C4H10 = C4H6 + 2H2.
A reakciók a másik két típusú száma reagensek egyenlő a termékek száma.
3. Csere reakciókat. A megkülönböztető jellemzője - egy egyszerű anyag kölcsönhatás komplex. Az ilyen reakciókat a szerves kémiában. Azonban, a „helyettesítés” a szerves anyag szélesebb körű, mint a szervetlen kémia. Ha a molekula A kiindulási anyag bármely atom vagy funkciós csoporttal van helyettesítve, egy másik atom vagy csoport, ez a szubsztitúciós reakció, is, bár abból a szempontból szervetlen kémia folyamat úgy néz ki, mint a kicserélődési reakciót.
Ha a helyettesítési reakciót általában egy egyszerű anyagot reagáltatunk egy képező szert, valamint más egyszerű bonyolultabb A + BC = AB + C
Például, csökkenti az acél szög réz-szulfát oldatot kapjunk vas-szulfát (vas réz elmozdul a só) Fe + CuSO 4 = FeSO4 + Cu.
Ezek a reakciók túlnyomórészt tartoznak redox
2AL + Fe2O3 = 2Fe + Al2O3,
Zn + 2 HCI + H2 = ZnSl2,
2KVr + Cl2 + Br2 = 2KSl,
2KSlO3 + L2 = 2KlO3 + Cl2.
Példák a szubsztitúciós reakciókkal, amelyek nem kíséri változást vegyértékű állapotban az atomok rendkívül kevés.
Meg kell jegyezni, szilícium-dioxid reakció oxigénezett savak sói, amelyek megfelelnek gáznemű vagy illékony anhidridek
CaCO3 + SiO2 = SaSiO3 + CO2
Ca3 (PO4) 2 + ZSiO2 = ZSaSiO3 + P2O5.
Néha ezek a reakciók tekinteni kicserélődési reakció
CH4 + Cl 2 + HCI = SN3Sl.
4. kicserélődési reakciók (beleértve semlegesítés). kicserélődési reakciók úgynevezett közötti reakciót két vegyület, amelyek között kicserélt összetevők
Nagy részük zajlik vizes oldatok. Egy példa a kémiai csere reakció az a sav semlegesítésének lúggal
Itt a reagenseket (anyagok maradt állva), a hidrogénion a vegyület HCI-cserélt nátrium ionokat a NaOH vegyületet, és oldatot eredményez, a só vizes.
Ha a helyettesítési reakció végbemegy redox folyamatokat, a kicserélődési reakció mindig fordul elő változása nélkül a vegyérték-állapotú az atomok. Ez a leggyakoribb csoport komplex reakciók közötti anyagok - oxidok, bázisok, savak és sók
ZnO + H2SO4 = ZnSO4 + H2O
AgNO3 + KBr = AgVr + KNO3,
SrSl3 ZNaON + = Cr (OH) 3 + ZNaSl.
A konkrét esetben ezeknek csere reakciók - semlegesítés
HCl + KOH = KCl + H2O.
Általában ezek a reakciók alá a törvények a kémiai egyensúly és az áramlás ebben az irányban, ha legalább az egyik anyag eltávolítjuk a reakciózónából, mint egy gáz-halmazállapotú, illóanyag vagy csapadék malodissotsiiruyuschego (megoldásokat) vegyület
NaHCO 3 + HCl = nátrium-klorid + H2O + CO2 ↑,
Ca (HCO3) 2 + Ca (OH) 2 ↓ + = 2SaSO3 2H2O,
SN3SOONa + H3PO4 + CH3COOH = NaN2RO4.
Azonban sok reakciók nem rakott a fenti egyszerű áramkört. Például egy kémiai reakció között a kálium-permanganát (kálium-permanganát) és nátrium-jodidot nem tulajdonítható, hogy ezek közül bármelyik típusú. Az ilyen reakciók nevükön a redox például 2KMnO4 + 10NaI + 8H2 SO4 = 2MnSO4 + K2 SO4 + 5Na2 SO4 + 5I2 + 8H2 O.
Ahhoz, hogy egy redox szervetlen kémia magában foglalja az összes szubsztitúciós reakciók és bomlási reakciók és azok a vegyületek, amelyek a játék legalább egy egyszerű anyagot. Egy általánosabb kiviteli alakban (a már megadott, és a szerves kémiában), az összes reakciót, amely egyszerű anyagok. Éppen ellenkezőleg, a reakciók haladva megváltoztatása nélkül oxidációs fokú az alkotó elemek a reaktánsok és a reakciótermékek közé tartoznak az összes kicserélődési reakció.
2. Besorolás reakciók fázisában kiemelt
Attól függően, hogy az aggregációs állapotától a reagensek következő reakciók:
1. Gáz reakciók:
2. Reakciók megoldások:
NaOH (aq) + HCI (p-p) = NaCl (p-p) + H2O (g).
3. A reakciók között szilárd:
CaO (szilárd) + SiO 2 (szilárd) = SaSiO3 (TV).
3. Besorolás reakciók szerint a fázisok száma
Fázistranszfer megérteni sor homogén részein a rendszer azonos fizikai és kémiai tulajdonságokkal rendelkeznek, és egymástól elválasztva a felületen.
Minden különböző reakciók, ebből a szempontból lehet osztani két osztályba.
1. Homogén (egyfázisú) reakciót. Ezek közé fellépő reakciók gázfázisban, és a különböző reakciók megoldásokat.
2. Heterogén (multi-fázis) reakciót. Ezek közé tartoznak a reakciók, amelyekben a reagensek és a reakció termékek különböző fázisokban. Például:
CO2 (g) + NaOH (p-p) = NaHCO 3 (p-p),
CO2 (g) + CaO (szilárd) = SaSO3 (TV),
Na2SO4 (aq) + VaSl3 (p-p) = VaSO4 (TV) ↓ + 2NaSl (p-p),
Ca (HCO3) 2 (aq) + H2SO4 (aq) = CO 2 (g) ↑ + H2O (g) + SaSO4 (TV) ↓.
4. Osztályozás reakciók típusú lebegő részecskék
Olvasd el: Protolytic reakció
Információ a munkáját „A koncepció a kémiai reakciók és azok besorolása”
Kategória: Kémia
Karakterek száma szóközökkel: 20245
Asztalok száma: 2
A képek száma 2
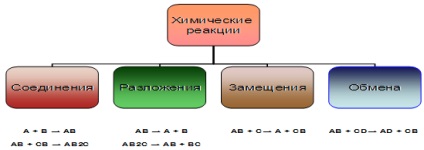
- a reakció megy megváltoztatása nélkül az oxidáció mértékét: S + 4O4-2 + H2O → H2 + S + 4O4-2 CH3NH2 + HCI → (CH3NH3) Cl Mint látható, vannak különböző módjai osztályozása kémiai reakciók, amelyek figyelembe vesszük részletesebben az alábbiak szerint. Alapján számának változása a kezdeti és végső anyagokat. Ott megtalálható 4 típusú kémiai reakciók (6. ábra): képletű vegyületet, a bomlási reakció.
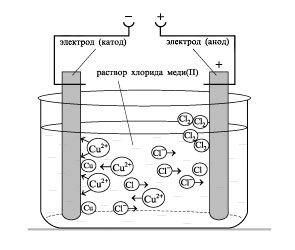
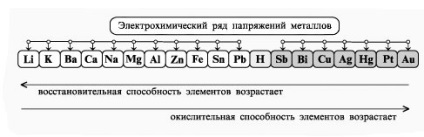
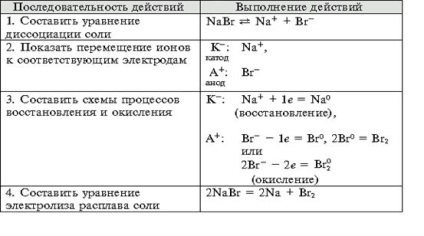
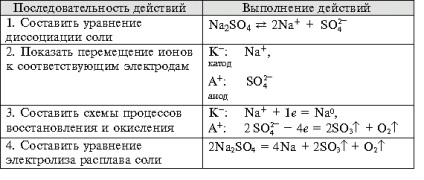
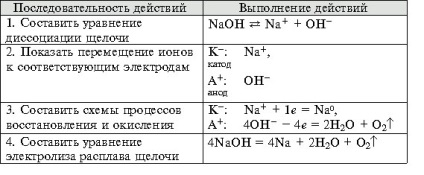
- Megalakult a kísérlet technológiai készségek, képes megoldani a tervezés és a minőségi célkitűzések, hogy az egyenlet a kémiai reakciók előforduló elektrolízis oldatok és olvadékok elektrolitov.- Oktatási függetlenség szervezet, megalakult a képesség, hogy egy csoportban dolgozni, fejlesztése kreatív képességeit, a logikus gondolkodás, a figyelem és a memória. Felszerelés: számítógép.
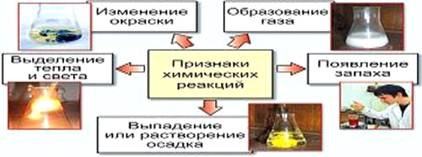
A reakcióközeg ebben az esetben függ az arány a disszociációs állandók a megfelelő savak és bázisok. Megerősítése hidrolízis hígításával, fűtési rendszer. 2. Kémiai reakciók kémiai reakció (kémiai jelenségek) - olyan folyamat, amely eredményezett néhány anyagokat átalakítják más. Jelek kémiai reakciók a következők: - a változó színek;.