ammónia sűrűségű (NH3), jelentését és példák
Sűrűség ammónia és egyéb fizikai tulajdonságai
Normális körülmények között, az ammónia színtelen gáz egy szúrós, fojtó szagú. ammónia sűrűsége 0,73 kg / m 3.
Ammónia-molekula kémiai összetétele, amely tükrözi a képlet NH3. Ez az alakja egy trigonális piramis (DNH = 0,10nm, HNH szög 0 = 107,3) (ábra. 1). Szerint vegyértékkötés elmélet megfelel sp3 -hybridization vegyértékei orbitálok nitrogénatom. A négy pályák sp3 -Hybrid három nitrogénatomot részt vesz a kialakulását három σ-kötést N-H, és a negyedik orbitális vesz kötő elektronpár. Ami a molekulapálya elmélet, ez megfelel töltse három kötési és egy kis kötés molekuláris σ-pályák:
Mivel nincs kötelező két-elektron felhő orientált az űrben, ammónia molekula - kifejezettebb donor elektronpár, és van egy nagy polaritású (m = 0,49 × 10 -29 m × Cl).
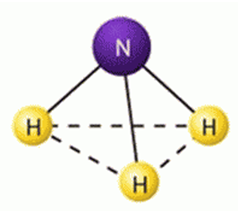
Ábra. 1. Szerkezet az ammónia molekula.
A polaritás az N-H kötések molekulák között, ammónia a hidrogénkötés. Ezért, az olvadáspont (-77,8 ° C) és a forráspontja (-33,4 ° C) ammóniát meglehetősen magas; ez jellemzi a nagy entalpia párologtatás és könnyen cseppfolyósított.
Folyékony ammóniát, mint a víz, - erősen ionizáló oldószert. Így származékai NH4 + folyékony ammóniával viselkednek, mint a savak (aminosavak) és származékai NH2 - -, mint a bázis (ammonoosnovaniya). Például, az erős savak folyékony ammóniában, NH4CI, NH4 NO3. és bázisok - KNH2. Ba (NH2) 2. Digidronitridy Zn (NH 2) 2. Al (NH2) 3 viselkednek, mint az amfoter vegyület.
Az ammónia nagyon jól oldódik vízben (20 o C-on egy térfogatú vízben feloldódik körülbelül 700 térfogatrész ammónia). Jó oldhatósága miatt a hidrogén kötések kialakulását a molekulák között az NH3 és a H2 O.
Az alábbiakban röviden ismertetjük a kémiai tulajdonságok és az ammónia sűrűsége
Ammónia rendkívül reakcióképes, hajlamos arra, hogy reakciók prisoedineniya.Sgoraet oxigén reakcióba lép savak, fémek, halogének, oxidok és halogenidek.
2NH3 + 2AL = 2AlN + 3H2 (t = 600 feletti o C).
Kvalitatív reakció ammónia - feketedés papír, smochennoyrastvorom Hg2 (NO3) 2 (higany képződés). Szárított kalcium-oxid, az ammónia.
Folyékony ammóniát - alap protikus oldószer; valamint rastvoryaetseru halogenidek (kivéve fluorid), és nitrátok az alkálifémek, galogenidyammoniya, kálium-permanganát; rosszul oldja a szervetlen fluoridok, szulfátok, karbonátok.
Példák problémák megoldása
Számítsuk ki a moláris tömege a gáz, amely a levegő sűrűsége 0,756.
Az arány a tömege gáz tömegének másik gázzal hozott az azonos mennyiségű ugyanazon a hőmérsékleten, és ugyanazt a nyomást, nevezzük a relatív sűrűsége az első gáz a második. Ez az érték azt jelzi, hogy hány alkalommal az első gáz nehezebb vagy könnyebb, mint a második gáz.
A relatív molekulatömege levegő hozott egyenlő 29 (a tartalma a nitrogénnek a levegőben, az oxigén és egyéb gázok). Meg kell jegyezni, hogy a „relatív molekulatömege levegő” kifejezést hagyományos értelemben használjuk, mint a levegő - gáz keveréke.
Dair (gáz) = M (gáz) / M (levegő);
M (gáz) = M (levegő) × Dair (gáz);
M (gáz) = 29 × 0756 = 22 g / mol.
Móltömeg a gáz egyenlő 22 g / mol.
Határozza meg a moláris tömege ismeretlen gáz, ha azonos térfogatú gáz és oxigén azonos körülmények van tömegek 4,15 g és 0,32 g
Az arány a tömege gáz tömegének másik gázzal hozott az azonos mennyiségű ugyanazon a hőmérsékleten, és ugyanazt a nyomást, nevezzük a relatív sűrűsége az első gáz a második. Ez az érték azt jelzi, hogy hány alkalommal az első gáz nehezebb vagy könnyebb, mint a második gáz.
Móltömeg jelentése hidrogénatom:
Ezután, a moláris tömege egy ismeretlen gázt
M (gáz) = M (O2) × DO2 (gáz) = 32 × 1328 = 42,5 g / mol.