atomi szerkezetének modell
modell Thomson
Az első modell az atomi szerkezet által javasolt J. Thomson 1904-ben, amely szerint az atom -. Egy pozitív töltésű gömb közbeszórt ez elektronokkal. Annak ellenére, hogy hiányosságai Thomson modell lehetővé teszi számunkra, hogy ismertesse a jelenségeket a kibocsátási, abszorpció és szórás a fény az atomok, valamint állítsa az elektronok száma az atomok a könnyű elemek.

Ábra. 1. Atom szerint Thomson modell. Az elektronok belülre korlátozódnak pozitív töltésű gömb rugalmas erők. Azok, akik a felszínen, könnyen „látszanak”. hagyva ionizált atomok.
2.2 Model Rutherford
Thomson modell cáfolták E. Rutherford (1911), akik kimutatták, hogy a pozitív töltés, és szinte az összes atomi tömegegység koncentrálódik egy kis része térfogatának - egy mag, amely körül elektronok (2. ábra).
Ábra. 2. Ez a modell a atomi szerkezete ismert, mint egy bolygó, t. K. Az elektronok a mag körül, mint a bolygók a Naprendszer.
Törvényei szerint a klasszikus elektrodinamika, a mozgás az elektronok az atommag körül a kör lesz stabil, ha a Coulomb vonzóerő egyenlő lesz a centrifugális erő. Ugyanakkor az elmélet szerint az elektromágneses mező, az elektronok ebben az esetben meg kell mozgatni spirálisan, folyamatosan sugárzó energia, és esik a sejtmagba. Azonban atommal stabil.
Ezen túlmenően, folyamatos kibocsátás származó energia az atom folyamatosan meg kell figyelni, a folytonos spektrum. Tény, hogy a spektrum az atom alkotja az egyes vonalak és sorozatok.
Így ez a modell ellentétes jogszabályok elektrodinamika és a vonal nem magyarázza a természet az atomi spektrum.
2.3. Bohr modell
1913-ban Niels Bohr elméletével atomszerkezetre nélkül tagadja teljesen az előző benyújtását. Az alapja az az elmélet Bohr hogy két kívánságot.
Az első posztulátum azt mondja, hogy az elektron lehet forgatni az atommag körül csak bizonyos fix kering. Tőlük azt sem bocsát ki és nem nyel el energiát (3. ábra).
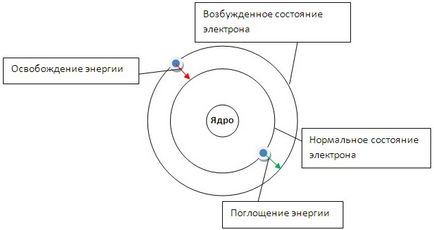
Ábra. 3. A szerkezet a Bohr atom modell. Állapotának megváltoztatásával egy atom az átmenet egy elektron egyik pályáról a másikra.
Amikor vezetés bármely stacionárius pályára a elektron energiaellátás (E1, E2 ...) állandó marad. Minél közelebb a lényege a pályán, annál kisebb a mozgástér ˂ E1 E2 elektron energia En ... ˂. Az energia az elektron kering adja meg:
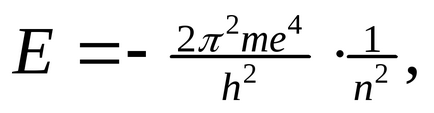
ahol m - az elektron tömege, h - Planck-állandó, n - 1, 2, 3 ... (n = 1 az első pályára, n = 2 a második, stb).
A második tétel azt mondja, hogy az átmenet az egyik pályáról a másikra elektron elnyeli, vagy elengedi a kvantum (rész) az energia.
Alávetése atomok hatások (hő, sugárzás, stb), az elektron képes felvenni egy kvantum energia, és mozgassa, hogy egy távolabbi pályára a sejtmagból (ábra. 3). Ebben az esetben beszélünk gerjesztett állapotban az atom. Ha döntetlen elektron halad (több, közel a nucleus pályára) energia formájában szabadul fel a kvantum sugárzó energia - foton. A spektrum bizonyos vezetékes. Formula alapján
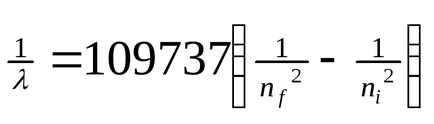
ahol λ - hullámhossza, n = kvantumszámok jellemző a proximális és disztális pályája Boron hullámhosszak számított összes sorozat spektrumában a hidrogénatom. Az eredmények megfelelnek a kísérleti adatok. Világossá vált az eredete a szaggatott vonal spektrumokat. Ezek - eredmény atomok energiájú sugárzás az átmenetet az elektronok a gerjesztett állapotból a steady-state. Transitions elektronok a pályán az 1. forma Lyman frekvenciasávban, a 2. - Balmer sorozat, a harmadik sorozat Paschen-(4. ábra, 1. táblázat ..).
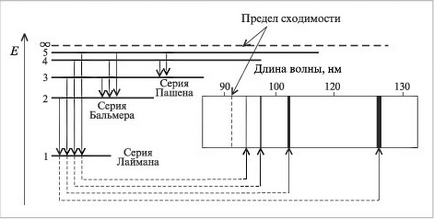
Ábra. 4. A megegyezést a elektron átmenetek és a spektrális vonalak atomos hidrogén.
Check Bohr képlet a hidrogén-spektrum sorozat