Általános és szervetlen kémia - Tutorial, 30. oldal
Amikor a fém nem merül bele a víz, és ez a fém-só oldatot egyensúly elvével összhangban a Le Chatelier eltolódott balra és nagyobb, minél nagyobb a koncentrációja az oldatban lévő fémionok. Az aktív fémek akinek ionok egy jó képessége, hogy megy oldatba, majd ebben az esetben negatív töltésű, bár kisebb mértékben, mint a tiszta víz.
Az egyensúlyi lehet jobbra tolódott, ha így vagy úgy, hogy távolítsa el elektronokat a fém. Ez vezet az oldódás a fémlemez. Ezzel szemben, ha a fémlemez, hogy elektronokat kívülről, a lerakodását az ionok az oldatból fog bekövetkezni.
Amikor a fém oldatba merítjük egy elektromos kettős réteg képződik a határfelületen. A potenciális különbség között felmerülő a fém és a környező folyadékfázis, az úgynevezett elektróda potenciálja. Ez a potenciális egyik jellemzője egy fém redox képessége, mint a szilárd anyag.
A szigetelt fématom (egyatomos gőz állapotban, amely akkor következik be, amikor a magas hőmérséklet és nagy vákuumban fok) redox tulajdonságokkal jellemezhető egy másik érték, az úgynevezett ionizációs potenciál. Ionizációs potenciál - ez a szükséges energiát, hogy egy elektront távolítanak el egy elszigetelt atom.
Az abszolút értéke az elektród potenciál nem mérhető közvetlenül. Azonban, nincs nehéz különbség mérés elektród potenciál, amely felmerül egy olyan rendszer, amely két pár fémből - oldatot. Az ilyen pár úgynevezett fél-sejtek. Feltételek határozzák meg az elektród potenciál a fémek vonatkozásában az úgynevezett standard hidrogén elektród potenciálját önkényesen nullának. Standard hidrogén elektród tartalmaz egy speciálisan előállított platina lemez savba merülő oldat hidrogén-ion-koncentráció 1 mol / l, és mossuk egy sugárhajtású hidrogéngáz nyomáson 105 Pa hőmérsékleten 25 ° C-on
Számos standardpotenciál. Ha a fémlemezt merítjük só oldat koncentrációja fémionok 1 mol / l, hogy csatlakozzon egy standard hidrogén elektród, akkor megkapjuk az elektrokémiai cella. A elektromotoros ereje ezen elem (elektromotoros erő) mérve 25 ° C-on, és jellemzi a standardpotenciál a fém, tipikusan jelöljük E °.
Standardpotenciál, meghatalmazotti redukálószerek között a hidrogéngáz, hogy a jel „-” és „+” van a standard potenciáljai az elektródák, amelyek oxidáló szerekkel.
Fémek, rendezett növekvő sorrendjében standardpotenciál alkotják az úgynevezett elektrokémiai sorban a fémek feszültségek: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni , Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Számos stressz jellemzi a kémiai tulajdonságai fémek:
1. A több negatív elektród potenciálját a fém, annál nagyobb a rugalmassága.
2. Minden egyes fém képes leszorítani (visszaállítási) azoktól fémek sóoldatok, amelyek az elektrokémiai sorban a fémek után stressz.
3. Minden olyan fém, melyek negatív standardpotenciál, azaz. E. Vannak az elektrokémiai sorban a fémek feszültségek maradt hidrogén, kiszoríthatja azt a savas oldatok.
Mivel abban az esetben, értékének meghatározása E ° fémek, nemfémek értéke E ° mérjük hőmérsékleten 25 ° C, és olyan koncentrációban atomi és molekuláris fajok bevont egyensúlyának 1 mol / l.
Az algebrai értéke a standard redox potenciál írja le oxidatív aktivitása a megfelelő oxidált formában. Következésképpen, az összehasonlítás az értékek
Normál redoxpotenciálok lehetővé teszi számunkra, hogy válaszoljon a kérdésre, hogy ez bekövetkezik, vagy a redox reakció?
A mennyiségi értékelésekor kritériumként előfordulásának lehetősége egy adott redox reakció pozitív értéke a különbség standard redox potenciál fele-reakciót az oxidációs és redukciós.
Hidrogén elektróda az elektrokémiai - általában platinával bevont lemezek merítjük savas oldatban egy bizonyos koncentrációja H + ionok és mossuk hidrogéngázzal. A hidrogén nyomás 0,1 MPa és a termodinamikai aktivitása annak ionok, egyenlő egy, a lehetséges egy hidrogén elektród hagyományosan nullának tekintjük. Ezt nevezik a standard hidrogén elektród, ez szolgál egy referencia elektród, amely számít a potenciálokat a másik elektródák.
32 termodinamikája elektróda folyamatok. Spontán redox reakciók. Kommunikációs EMF a sejt a Gibbs energia. Kommunikáció az egyensúlyi állandó EMF
Bármely kémiai reakciók mozgásával kapcsolatos elektronok, és ezért lehet előállításához használt elektromos áram. Ha ez a villamos energia forrása a felszabaduló energia kémiai reakció. Egy ilyen átalakítás kémiai reakció elektromos energiává csak akkor lehetséges, egy speciális eszköz úgynevezett galvanikus elem. Ez lehetővé teszi, hogy közvetlenül az elektronok áramlását a fém vezetékek.
Egyszerű a hidrogén elégetése kíséretében nagy hőleadás. Ha végzett állandó térfogatú, mint például egy kaloriméter bomba, a DU = -284,5 kJ / mól. Ha ugyanezt a reakciót végezzük egy elektrokémiai galvánelem által, egy részét a belső energia veszteség lehet előállításához használt elektromos áram. Vezetési ilyen elektrokémiai cella ábrán mutatjuk be: IX.1. A vizes oldatot (például nátrium-hidroxid) két platina elektróda elmerül. A bal oldali elektróda mossuk buborékok hidrogén, és a megfelelő - az oxigénnel. Hidrogén a bal oldalon a cella oldjuk platina és ionizálódik. Mivel a nagy affinitású a vízmolekulák számára egy bizonyos számú protonok belép az oldat réteget közvetlenül szomszédos az elektróda. Ebben a formában a hidróniumionok H3O + - azok meg vannak jelölve előnyei a jobb oldali ábra. IX. 1, míg az elektronok (mínusz) maradnak a platina elektród felületén. Miatt közötti elektrosztatikus vonzás elektronok és ionok oxónium utóbbi továbbra is az elektróda közelében, és nem megy oldatba kötetet. Ennek köszönhetően a fém-oldat, egy úgynevezett villamos kétrétegű hasonló a két lemez a kondenzátor. A jobb az elektród felületét reakció megy végbe a kialakulását a hidroxil ionok:
3 / 2O2g H3Ozh + + 2e = 2OH-
eredményeként, amely a két elektron a fém eltávolítjuk. A fémfelület pozitív töltésű és ezért is képződik a villamos kettős réteg, de ellenkező előjelű. Ha összevetjük a bal és a jobb fémes vezetőt elektródák, az áramlás a villamos áram hozzá. A nyíl látható. IX.1 jelzi az áramlás irányában az elektronok. Az elektromos potenciálkülönbség az elektródák nyitott elektrokémiai cella hívják elektromotoros erő (pl. G. P.).
Úgy látszik, az elektronok áramlását, előforduló a sejt lehet használni, hogy készítsen a munka, például forgathatóan a villamos motor. Az áram csökkenéséhez vezet díjak elektromos kettős réteg. Ezért H3O + ionok és OH- képesek kell távolítani az elektródok alkotnak vízmolekulák semleges oldatban. Egyidejűleg miatt reakciók az elektródák újra helyreáll kettősrétegeket. Előforduló az elektródák és az oldatot változások megjelennek az alábbi egyenletekkel:
3/2 O2g H3Ozh + + 2e = 2OH-;
az összege, amely egy reakció, amely során víz:
H3G + 1 / 2O2g = H3Ozh,
Ily módon ugyanaz a reakció víz kialakulása az elemek lehet tenni két különböző módon. Hogy ezen eljárások kedvezőbb szempontjából az átalakítás a kémiai energiát a reakció a munkálatok? Az első módszer szerint az égés hidrogén bombában kaloriméter (V = const) 298 K csökkenése a belső energia egyenlő a szám a kivont hő -du = 284,5 kJ / mól, és a munka nulla.
A második esetben, a részét a belső energia változás (DG) lehet alakítani elektromos munka. Ha a reakciót egy sejtben reverzibilis, a kísérő csökkenése a Gibbs energia teljesen megy a termelés elektromos munka.
Ebben az esetben a DG0 = -237,2 kJ / mól, és így csak a ~ 47 kJ / mol hővé alakul. Ez a példa azt mutatja, hogy az összes energia égése során felszabaduló természetes üzemanyagok előnyös közvetlenül alakítani elektromos energia, mivel a. N. D. Heat motorok és hőteljesítmény kicsi. A fenti hidrogén-oxigén cella egy példa az úgynevezett üzemanyagcelláját.
A munka a létrehozása az ilyen elemeket a közelmúltban fejlesztettek ki széles körben, összefüggésben az új technológiai kihívásoknak. Az ezen elemek a tüzelőanyag és az oxidálószer külön kell tárolni, és táplálnak az elektródokhoz, amelyben elektrokémiai reakciókat. Amikor ez az elem folyamatosan működik, ha hozzá összefoglalja a reaktánsok és a reakciótermékek kiürítjük, ami különösen kényelmes, ha a folyékony és gáz halmazállapotú anyagok. Ahelyett, hogy a szén égési reakciót alkalmazhatjuk Cm + = O2g SO2g előállítani egy elektromos áram.
Nyilvánvaló, hogy a tényleges munka galvánelemek visszafordíthatatlanul, így a munka részévé válik a változás a Gibbs energia a reakció folyik az elem. Megismételjük, hogy az elektrokémiai cella lehet működtetni a feltétellel az áramlása benne spontán kémiai reakció, vagy bármely más, spontán folyamat kíséri a Gibbs energiaveszteséget.
Ha tartják, hogy magába zárja a sejt elem kívülről elég nagy potenciál különbség túllépte a Oe. d. a. és miután az ellenkező irányba, akkor az expanziós fordulnak elő a víz kibocsátása a hidrogén és oxigén. Így a folyamatok termelnek egy elektromos áram az elektrolizáló cellákban, és kölcsönösen ellentétes.
A jellemzője az elektrokémiai folyamat a sejt fontos a lehetőségét elmélet ezek körülmények között nagyon közel az átalakítható. Ezt úgy érjük el, potenciometriás módszerrel, amelyben pl. d. a. tanulmányozta a sejt szinte teljesen kompenzálni, egymással ellentétes irányú EMF a. külső forrás. Ez a technika lehetővé teszi a mérést az EMF hiányában a jelenlegi az áramkörben, azaz amikor az elem nem működik, és az EMF maximum. Ellenőrzésén hiányában jelenlegi galvanométert (null eszközök) magas érzékenység. Feltéve, hogy a szórás közben áramot engedünk 10-8 - 10-9 A. Ez az alacsony áram, amikor áthalad az elektrolit még nem tud évekig kiemelni jelentős mennyiségű anyagot.
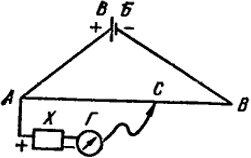
Ábra. IX.2. Reakcióvázlat elektromotoros erőt mérő fizetési módot.
Sematikus ábrája a mérési e. d. a. elektrokémiai cella kompenzációs ábrán látható eljárás. IX.2. DC áram a kisegítő akkumulátor VB táplálunk a végei a dia huzal AB - huzal állandó szakaszt. Ezért a feszültségesés hossza mentén a dia huzal arányosan megfelelő szegmensével a vonalon AB. A mozgatható érintkező C lehet kiválasztott tetszőleges része közötti feszültségesés A és B pontok tól ábra. IX.2 látható, hogy a feszültség vett adott területen a dia huzal, mint az AC, felé irányul e. d. a. elem X.
A mozgó érintkező a dia huzal, megtalálása a helyzetbe, amelyben a nulla-galvanométer G hiányát jelzi áram AHGS láncban. Ez azt jelenti, hogy a feszültségesés a WB az AC szakasz teljesen kompenzálni e. d. a. elem X.