A kapcsolat a ozmózisnyomás és ozmolaritása
A kapcsolat a ozmózisnyomás és ozmolaritást. A ozmolaritását testfolyadékok
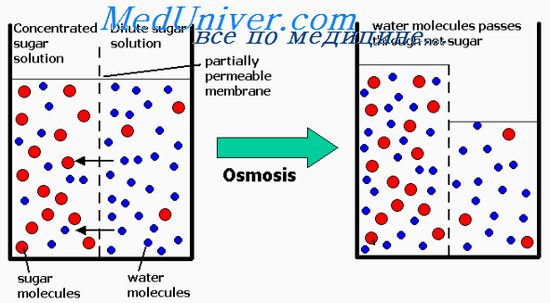
A ozmózisnyomása az oldat egyenesen arányos a koncentrációja abban feloldott részecskék. Ez igaz mind oldott, nagy és kis méretű molekulák. Például, az egyik albumin molekula molekulatömege 70.000 teremt az azonos ozmotikus hatása, mint egy molekula glükózból, a molekulatömeg egyenlő 180. Egy molekula NaCl, azonban rendelkezik két ozmotikusán aktív részecskék: ionok Na + és Cl, ozmotikus hatást, amely (szemben a albumin vagy glükóz) egy 2-szer magasabb, így az ozmotikus nyomás az oldat arányos a ozmolaritása - mint az oldott részecskék.
A szabálynak megfelelően van't Hoff ozmolalitása (n) kiszámítható a következő képlettel: a = CRT, ahol C - az oldott anyag koncentrációja a ozmolit literenként, R - egyetemes gázállandó és T - a hőmérséklet Kelvin fokban (273 ° + Hőmérséklet Celsius). Ha k fejezzük hagyományos egységek biológiai folyadékokban - Hgmm, T megfelel egy normál testhőmérséklet a (273 ° + 37 ° = 310 ° Kelvin), a számított érték I egy 1 OSM / l lesz 19,300 Hgmm. Art. Ez azt jelenti, hogy a koncentráció 1 mOsm / l egyenlő 19,3 Hgmm. Art. Így minden milliozmol transzmembrán koncentrációgradiens ozmózis nyomást hoz létre a 19,3 Hgmm. Art.
Feltételezve, hogy a membrán impermeábilis és az oldott anyag lehet ki lehet számítani az ozmotikus nyomás az oldat felhasználásával a van't Hoff-szabályt. Például, az ozmotikus nyomás egy 0,9% nátrium-klorid-oldatot a következőképpen számítjuk ki: 0,9% azt jelenti, hogy a 100 ml oldat tartalmaz 0,9 g nátrium-klorid, vagy a 9 g / l. Mivel a molekulatömege NaCl 58,5 g / mol, a molaritása a megoldás: 9 g / l osztva 58,5 g / mol, vagy 0,154 mol / liter. Mivel minden egyes molekula nátrium-klorid ekvivalens 2 ozmolaritása, az oldat ozmolalitása lesz: 0,154x2, vagy 308 mOsm / l. Ezért, a ozmolaritása az oldat 308 mOsm / L. Lehetséges ozmózisnyomása az oldat: 308 mOsm / l x 19.3 Hgmm. Art. vagy 5944 Hgmm. Art.
Ez a számítás egy közelítése, mivel az oldatban miatt ion-ion kölcsönhatás erők közötti ionok Na + és Cl- van teljes függetlenség. Elméletileg kiszámított van't Hoff szabály az értéket ki kell igazítani, figyelembe véve a módosításokat, amelyek nevét viseli ozmotikus koefficiens. Ahhoz, hogy ez 0,93 NaCl. Következésképpen, a tényleges értéke 0,9% NaCl oldattal ozmolaritása mennyiségű 308x0,93, vagy 286 mOsm / l. A gyakorlatban, a meghatározó ozmolalitás és az ozmotikus nyomás a felhasznált oldat infúziós állítva az ozmotikus koefficiens néha elhanyagolnak.
A ozmolaritását testfolyadékok. Figyeljünk a hozzávetőleges ozmolaritását különböző oldott anyagok a plazmában, intercelluláris és intracelluláris folyadékban. Vegye figyelembe, hogy mintegy 80% -a az összes ozmolaritás a intersticiális folyadék miatt az ionok Na + és Cl, mivel az intracelluláris folyadék ozmolaritása közel fele a K + ionok keletkezett, és a maradék oszlik az ionok más anyagok.
Teljes ozmolaritása mindhárom fő testnedvek körülbelül 300 mOsm / l. Összehasonlítva az intercelluláris és intracelluláris folyadékban plazma ozmolaritás 1 mOsm / l feletti. Ez a kis különbség miatt a fehérjéket, amelyek fenntartják a lumen a kapillárisok egy nagynyomású (a fenti 20 Hgmm. V.), mint a környező interstitialis folyadék.
„Kiigazított értéke ozmolaritása testnedvek. Az alsó sorban a táblázat mutatja az érték a „korrigált plazma ozmolaritása, intercelluláris és intracelluláris folyadékban. Az ok bevezetésének korrekciók vonzó és taszító erők közötti ionok, vagy molekulák az oldatban okozó, illetve enyhe növekedés vagy enyhe csökkenése ozmotikus „aktivitás” oldott anyag.
A teljes ozmózisnyomás testfolyadékok. A táblázat azt is mutatja, a teljes értékek az ozmotikus nyomás a különböző folyadékok, mért különböző oldalain a membrán, az egyik oldalán van desztillált vízbe merítjük. Megjegyezzük, hogy a teljes nyomás a plazmában egyenlő a termék a „korrigált plazma ozmolalitás (282 mOsm / l) a következő tényezők 19.3. Ennek eredményeként, megkapjuk 5443 Hgmm. Art.