Előadások a fizika elmélete gázokra most már beszélt a nyomás egyetlen gázt
Eddig már beszéltünk a nyomás egy gáz - oxigén, hidrogén, stb, de a természet és a technológia, gyakran kell foglalkozni a keverék több gázok ... A legfontosabb példa erre - a levegő, a keveréket nitrogén, oxigén, argon, szén-dioxid és egyéb gázok.
Gázkeveréket értünk keverékét egyes gázok belépő egymáshoz tetszőleges kémiai reakció. Mindegyik gáz (komponens) a keverékben, függetlenül más gázokat teljesen megtartja annak minden tulajdonságait, és úgy viselkedik, mintha az egyik kitölti a teljes keverék térfogatát.
Mi határozza meg a gáz nyomása?
Tedd be a lombikba darab anyag-va kémiailag kötő savanyú fajta levegő (például foszfor) és a gyorsan zárja a lezárt lombikban egy cső-tuple. csatlakoztatott higanyos manométerrel. Egy idő után, a levegő oxigén egyesül a foszfor. Látni fogjuk, hogy a mérőeszköz jelzi kisebb nyomás, mint korábban az oxigén eltávolítása végett. Ennélfogva, a jelenléte a levegőben levő oxigén növeli a nyomást.
A pontos kutatási nyomású gázkeverék először elő a brit kémikus John Dalton 1809
Állítsa (1803) törvény többszörös arányok, bevezette a „atomi tömeg”, az első, hogy meghatározza az atom súlya (tömege) számos eleme. Kinyitom gáztörvények hogy ő nevét viseli.
Úgy tartják, hogy az első pontos leírást színvakság adta 1794-ben, az angol kémikus Dalton, hogy pontos legyek - Dalton (John Dalton). Ezért az adat anomáliák kapta a nevét a „színvakság”.
Angol John Dalton, annak ellenére, hogy elutasítja, élt 78 évet.
Volt három testvér és egy nővére, két testvér is szenvedett tsvetoslepotoy piros.
Abban az időben, mi nem tud semmit a gének és a törvények szabályozzák, hogy öröklés, de Dalton részletesen ismertetik a családja hiba, és az ő felfogása a világban. Hála a leírás az ő hibája, az ő neve már 200 éve ismert, hogy minden iskolás.
A történelem arra tanított, hogy sokszor minden ötletes emberek érzékelik a körülöttük lévő világot, és a természet a jelenség nem annyira, mint mindenki másnak. Ez nekik köszönhetjük az új felfedezések és találmányok.
Tsvetoslepye egy színt, és a csökkent színlátás színek érzékelhető az őket körülvevő világot másként, de gyakran nem veszik észre a különbségeket másoktól. Néha észre sem és a környező. Tehát, Dalton, amely nem tesz különbséget a piros, nem tud a színvakság legfeljebb 26 év.
Annak érdekében, hogy megértsük, miért a gázok légköri képez keveréket bizonyos fizikai tulajdonságok, de nem található egymás alatt rétegek sűrűségük alapján, azt találtuk, hogy a viselkedését a gáz nem függ a keverék összetételétől; megfogalmazott törvénye gázok parciális nyomásának, felfedezte függését oldhatóságának gázok részleges nyomását.
A nyomás, ami lenne egyes gázok alkotó keverék, ha távolítsa el a maradék gázok által elfoglalt térfogat a keveréket az úgynevezett parciális nyomású gáz. Dalton találtuk, hogy a nyomás a gázkeverék az összege parciális nyomásainak összetevői (Dalton-törvény).
Dalton-törvény kimondja nyomás a keverék egyenlő a parciális nyomása a gázok a keverék előállítása. . Ez az úgynevezett parciális nyomása.
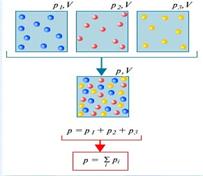
Tekintsünk egy gáz molekulákból álló különböző anyagok, amelyek térfogata V. miatt véletlenszerű termikus mozgás a molekula minden egyes eleme a keverék egyenletesen lesz elosztva az egész mennyiség, azaz mintha a másik összetevője a gáz nem álltak rendelkezésre. Mivel az állandó molekuláris ütközések egymással kíséretében részleges közötti impulzusok és energiák, a termikus egyensúly jön létre az elegyben. Mindez azt eredményezi, hogy az a tény, hogy a nyomás az egyes komponensek a keverék nem függ a jelenléte a többiek.
Ezután, a kapott nyomás határozza meg a teljes nyomás az összes komponens.
Megjegyzendő, hogy egy erősen tömörített gázok Dalton-törvény nem alkalmazható, valamint a törvény Boyle - Mariotte.
A termodinamika első főtétele (PNT)
Tegyük fel, hogy termodinamikai rendszer (például tartalmazott gáz a hengerben, a dugattyú alá), amelynek a belső energia U1, kapott egy bizonyos mennyiségű hő Q és megy, egy új állam, azzal jellemezve U2 belső energia, munka elvégzésére a külső környezet A, azaz a . külső erőkkel szemben. Ebben az esetben a Q = U2-U1 + A vagy
(4) egyenlet fejezi POT: hő adódik át a rendszer, akkor fordított a változás a belső energia és hogy ez a munka külső erőkkel szemben.
A infinitezimális folyamatok expresszió (4) van rögzítve formájában eltérés dQ = dU + dA vagy több megfelelő formában
mivel csak a teljes eltérés dU és d Q d és összesen különbségek nem.
Tól (5) az következik, hogy a hőmennyiség a SI expresszálódik ugyanabban az egységben, és hogy a munka az energia, azaz a joule (J).
Ha a rendszer periodikusan visszatér az eredeti állapotába, a változás belső energia D U = 0. Ezután szerint a (4), azaz A = Q. egy örökmozgó az első fajta, ami lett volna egy nagy munka ez, mint a bejelentett külső erő nem áll rendelkezésre. Ez az egyik a készítmények az első főtétele.