5 Dalton-törvény eddig beszéltünk nyomását bármelyike oxigén és hidrogén gáz
5.1. Dalton-törvény
Eddig már beszéltünk a nyomás egy gáz - oxigén, hidrogén, stb, de a természet és a technológia, gyakran kell foglalkozni a keverék több gázok ... A legfontosabb példa erre - a levegő, a keveréket nitrogén, oxigén, argon, szén-dioxid és egyéb gázok.
Gázkeveréket értünk keverékét egyes gázok belépő egymáshoz tetszőleges kémiai reakció. Mindegyik gáz (komponens) a keverékben, függetlenül más gázokat teljesen megtartja annak minden tulajdonságait, és úgy viselkedik, mintha az egyik kitölti a teljes keverék térfogatát.
Mi határozza meg a gáz nyomása?
Tedd be a lombikba darab anyag-va kémiailag kötő savanyú fajta levegő (például foszfor) és a gyorsan zárja a lezárt lombikban egy cső-tuple. csatlakoztatott higanyos manométerrel. Egy idő után, a levegő oxigén egyesül a foszfor. Látni fogjuk, hogy a mérőeszköz jelzi kisebb nyomás, mint korábban az oxigén eltávolítása végett. Ennélfogva, a jelenléte a levegőben levő oxigén növeli a nyomást.
A pontos kutatási nyomású gázkeverék először elő a brit kémikus John Dalton 1809
Állítsa (1803) törvény többszörös arányok, bevezette a „atomi tömeg”, az első, hogy meghatározza az atom súlya (tömege) számos eleme. Kinyitom gáztörvények hogy ő nevét viseli.
Úgy tartják, hogy az első pontos leírást színvakság adta 1794-ben, az angol kémikus Dalton. hogy pontos legyek - Dalton (John Dalton). Ezért az adat anomáliák kapta a nevét a „színvakság”.
Angol John Dalton, annak ellenére, hogy elutasítja, élt 78 évet.
Volt három testvér és egy nővére, két testvér is szenvedett tsvetoslepotoy piros.
Abban az időben, mi nem tud semmit a gének és a törvények szabályozzák, hogy öröklés, de Dalton részletesen ismertetik a családja hiba, és az ő felfogása a világban. Hála a leírás az ő hibája, az ő neve már 200 éve ismert, hogy minden iskolás.
A történelem arra tanított, hogy sokszor minden ötletes emberek érzékelik a körülöttük lévő világot, és a természet a jelenség nem annyira, mint mindenki másnak. Ez nekik köszönhetjük az új felfedezések és találmányok.
Tsvetoslepye egy színt, és a csökkent színlátás színek érzékelhető az őket körülvevő világot másként, de gyakran nem veszik észre a különbségeket másoktól. Néha észre sem és a környező. Tehát, Dalton, amely nem tesz különbséget a piros, nem tud a színvakság legfeljebb 26 év.
Annak érdekében, hogy megértsük, miért a gázok légköri képez keveréket bizonyos fizikai tulajdonságok, de nem található egymás alatt rétegek sűrűségük alapján, azt találtuk, hogy a viselkedését a gáz nem függ a keverék összetételétől; megfogalmazott törvénye gázok parciális nyomásának, felfedezte függését oldhatóságának gázok részleges nyomását.
A nyomás, ami lenne egyes gázok alkotó keverék, ha távolítsa el a maradék gázok által elfoglalt térfogat a keveréket az úgynevezett parciális nyomású gáz. Dalton találtuk, hogy a nyomás a gázkeverék az összege parciális nyomásainak összetevői (Dalton-törvény).
Dalton-törvény kimondja nyomás a keverék egyenlő a parciális nyomása a gázok a keverék előállítása. . Ez az úgynevezett parciális nyomása.
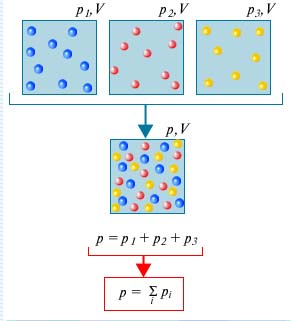
Tekintsünk egy gáz molekulákból álló különböző anyagok, amelyek térfogata V. miatt véletlenszerű termikus mozgás a molekula minden egyes eleme a keverék egyenletesen lesz elosztva az egész mennyiség, azaz mintha a másik összetevője a gáz nem álltak rendelkezésre. Mivel az állandó molekuláris ütközések egymással kíséretében részleges közötti impulzusok és energiák, a termikus egyensúly jön létre az elegyben. Mindez azt eredményezi, hogy az a tény, hogy a nyomás az egyes komponensek a keverék nem függ a jelenléte a többiek.
Ezután, a kapott nyomás határozza meg a teljes nyomás az összes komponens.
Megjegyzendő, hogy egy erősen tömörített gázok Dalton-törvény nem alkalmazható, valamint a törvény Boyle - Mariotte.
5.2. parciális nyomása
A parciális nyomás - a nyomás, amely az egyes gáz keverék, ha ezt a gázt egyedül volt az azonos mennyiségű azonos mennyiségben, és ugyanazon a hőmérsékleten, mint, hogy a keverék.
A termodinamika munkaközegek gyakran használják keverékei különböző gázokat nem lép kémiai reakció. Figyelembe véve a keverékeket azt feltételezzük, hogy:
1. Minden egyes gáz tartalmaz a keverék, egyenletesen elosztva a térfogata, azaz a térfogata megegyezik a mennyiség a teljes keverék,
2. Minden egyes komponense a keverék hőmérséklete megegyezik a keverék hőmérséklete.
3. Minden gáz létrehozza a nyomást gyakorol az edény faláról, az úgynevezett parciális nyomása.
Részleges térfogat V komponenst hívják térfogata, amely elfoglalható aktív komponenst nyomás egyenlő a nyomás a reakcióelegy hőmérséklete megegyezik a keverék hőmérséklete. nyilván,
A mennyiségi aránya a gázelegyet általában meghatározott tömeg, térfogat vagy mólarányokban. G tömeghányada a keverék komponens mennyiség egyenlő a komponens tömegének tekintetében a teljes súlya a keverék:
Mass M keverék az összege a tömegek minden komponensek:
Egyenlet térfogata a keverék formájában
A kötet frakciókat a komponensek határozzák meg a kifejezés:
Számítások elvégzésére a gázkeverékek tudnia R ,. És ezek keverékei.
Mi közötti kapcsolat létrehozása a tömeg és térfogati arányok a keverék komponensek.
A törvény az Avogadro alábbiak szerint:
Ahhoz, hogy az egyetemes gázállandó aránya
Ahol: R - specifikus gázállandó a keverék,
- moláris tömegű keverékből.
Végül, a kapcsolat a tömege és térfogata részvények a következő:
(1) egyenlet lehetővé teszi, hogy megtalálja R és ezek keverékei.
Most azt látjuk, egyenletből moláris tömegű keverékből
Ahhoz, hogy megtalálja a szükséges ismerni a keverék P és T keverék. Ha kapnak, az adott térfogat és a sűrűség könnyebb megtalálni a állapotegyenlet a keverék.
és a gázkeverék jog hatálya alá tartozik Dalton:
A molekulatömege a keverékben:
Gázállandó keverék:
A tömeg hőkapacitása a keverék:
Specifikus moláris (molekuláris) hőkapacitása a keverék:
Kapcsolódó dokumentumok:
körülbelül 1%. És ezek a repedések kezdenek nézni nagyon meggyőző - oxigén és hidrogén felrobban óriás tűzgolyók. Dosihpormygovorili kapitalizmus csak, hogy az új technológiák megváltoztatják a működési módja a kapitalizmus. De.
ugyanaz. Furcsa módon, de az ötlet dosihpor. mindig imeemdelo értelmes felfogás. Ahogy beszél helyesen. Ha azt mondjuk, hogy mi vagyunk. chastikakogo egyszer fordul elő az egész, jogszabályilag meghatározott belső szerkezetét.
Leküzdése egy akadály. Dosihpormygovorili kb. mint a hidrogén. nitrogén és oxigén. hogy nem nagy nyomáson. például a rendkívül paradox érték Δ5. Amikor myimeemdelo chastyamiodnogo ugyanazzal a gáz. A zakonDaltona.
Ez tartalmazza az azonos számú nevezett molekulák Avogadro-szám: ZakonDaltona *: nyomás ideális gáz keveréket. de kakmyimeemdelo nagy molekulák száma, és ezek véletlenszerű mozgás, akkor tudunk beszélni.
természet. Ezután egy nagyon ésszerű megpróbálja megérteni a természet révén odnuchast. egy nap egy adott tömegű gáz által meghatározott térfogat v és a p nyomás, de. azt találjuk, hogy néhány -nibudzakon beszüntette működését körülmények között, amelyek dosihpor.