Mi kovalens kötés az úgynevezett delta-csatlakozás és néhány π-kötés szétszedni a szerkezet például - iskola
Szigma-kötés (σ) - jelentése vegyértékkötés, elektron felhők által alkotott összekötő vonal atommagba. Egyszeres kötések mindig σ-kötések.
Pi-kötés (π) - egy kötés képződik az átfedési elektron felhők mindkét oldalán összekötő vonal az atommagba.
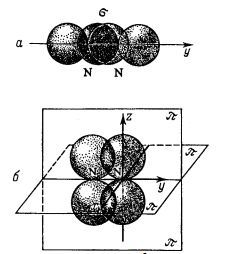
A nitrogén-atommal, amelynek elektron konfigurációját 1S ^ 2; 2s ^ 2; 2p ^ 3 három p orbitálok elrendezett egymásra merőleges irányban - a tengelyek x, y és z. Tegyük fel, hogy két nitrogénatom egymáshoz közel, mozgó tengely mentén Y. Ezután, amikor elegendő konvergenciája két 2py-orbitális átfedés, amely egy közös elektron felhő, amely található a tengely mentén összekötő atommagok (ábra.). A kovalens kötés által alkotott elektron felhő a legnagyobb sűrűségű a a középpontokat összekötő egyenes az atomok nevezzük szigma-kötés.
Nézzük meg, mi történik, páratlan elektronnal a nitrogén atomok a megközelítés. Ábra. bemutatott 2pz-hullám funkcióit elektronok nitrogénatomok. Az pályákat is fedik egymást. De ellentétben a közvetlen átfedése pályák kialakulását σ-kommunikáció, akkor bekövetkezik az oldalirányú átfedés. Ennek eredményeként, két régió átfedési vannak kialakítva, amelyek úgy vannak elrendezve mindkét oldalán összekötő vonal az atommagok atomok, a síkra, amely áthalad a tengely Z és Y jelentése a szimmetriasíkjában az átfedés régiók. A kovalens kötés által alkotott elektronok, amely a legnagyobb orbitális átfedés mindkét oldalán az a középpontokat összekötő egyenes az atomok, az úgynevezett pi-kötés.
Nyilvánvaló, hogy a két-elektron 2px nitrogénatomok alkotják egy második π kötést, amely körül van elhelyezve egy átmenő sík tengelyek y és x. Így, a molekulában, három kémiai kötések nitrogén, de ezek a kapcsolatok nem ugyanaz: egy σ-kötést és a másik két - π-kötés.