A belső energia rendszer

Home | Rólunk | visszacsatolás
Két alapvető típusa az energia - a kinetikus (okozta test mozgása) és a potenciális (mivel a helyzet a testre vagy annak az űrben). Ez a két típusú energia nyilvánulnak különböző formákban, mint például a termikus (hő), könnyű (sugárzási energia), kémiai, villamos energia, vagy más formában.
A törvény szerint az energiamegmaradás. Energia nem jön létre a semmiből, és nem pusztul el, és terjedt az egyik testből a másikba, vagy átalakított egyik formából a másikba. Ezért, ha az eljárás során az eltűnő energia egy bizonyos típusú, úgy tűnik, ahelyett, hogy azonos mennyiségű energiát más jellegű. Mi vonatkozik az ötlet az energiamegmaradás kémiai rendszerekben.
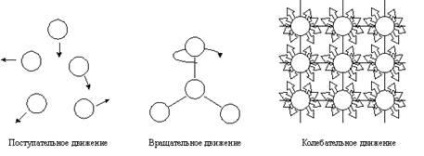
Ábra. 4.1. Típusú mechanikus mozgást.
Atomok, molekulák vagy ionok alkotják, hogy a kémiai rendszer a potenciális és kinetikus energia. A kinetikus energiát a mozgás a részecskék. Ez a mozgás lehet transzlációs, rotációs, és rezgési (Fig.4.1).
A típus a kinetikus energia hő. mivel kapcsolódik a mozgás az atomok és molekulák. A potenciális energia a részecskék által okozott azok kölcsönhatása egymással. Például, az elektronok az atom rendelkeznek potenciális energia tekintetében a pozitív töltések és a sejtmagban. A kötési energia - is egy formája a potenciális energia. Törés és kialakított kémiai kötésen kíséri változás potenciális energia, mivel a kémiai kötések a reakció termékek és a kiindulási anyagok eltérhetnek.
A összege potenciális és kinetikus energiáját az összes részecske a rendszerben (kivéve a kinetikus és potenciális energiája a rendszer egészének) egy olyan rendszer, a belső energia (U). U abszolút értéke nem határozható meg, mivel lehetetlen, hogy a rendszer olyan állapotba mentes energiát.
A belső energia függvénye a rendszer állapotáról, így a változás (DU) képlet adja meg:
A változás a belső energia a rendszer akkor jelentkezik, ha az erőátviteli rendszer vagy a belőle. Két alapvető módja az energia transzfer - hőátadás és a munka teljesítményét. A átadása által okozott energiát a hőmérséklet különbség a rendszer és környezete között vagy egy rendszer és egy másik rendszer úgynevezett hőátadás. Az energia mennyisége átadott ezáltal jelöljük Q (J), és egyenlő:
ahol m - a rendszer tömege (kg)
DT - a hőmérséklet-változás (K),
C - fajhője az anyag, amely magában foglalja a rendszer (J / (kg · K)).
A hő nem egy tulajdonság a rendszer, így nem lehet a funkciója a rendszer állapotáról.
Egy másik formája az energia átadása a munka - W (J). Vannak különböző típusú munkák. A kémiában a munka leggyakrabban társított a rendszer bővítését. Az ilyen irányú zajlik gázfejlődés a reakció során. Ebben az esetben a munkát, amelyet a rendszer, adja meg:
ahol P - külső nyomás (Pa), számos kémiai reakciók, a külső nyomás atmoszférikus;
DV = V2 - V1 - változása rendszer térfogata (m 3).
Így a változás belső energia (DU) a zárt rendszer megegyezik a különbség juttatott hő Q rendszer és teszi dolgozni, azaz a
Ez a kapcsolat az úgynevezett első főtétele. Ez a törvény az egyik készítmény az energiamegmaradás törvényének. mert azt mutatja, hogy a változás a belső energia a rendszer (DU) van kötve csak a energiaátviteli rendszer vagy belőle.
4.4.1. Standard képződési entalpia. entalpia
Általában, a kémiai reakciók kíséri hőhatás. Termikus hatást nevezzük összes energia mennyiségének megjelent vagy szívódik fel a reakció-rendszer, végzett állandó hőmérsékleten. Szakasz a kémia, hogy a tanulmányok a hőhatás a kémiai reakciók és fázisátalakulások, az úgynevezett termokémia.
Az első szerint főtétel (egyenlet 4.6), vagy a néhány kiválasztott elnyelt hő Q rendszer által meghatározott egyenlettel:
Behelyettesítve (4.5), (4.6), kapjuk a következő egyenletet:
határozza meg a standard képződési entalpia. Egyenletből (4.7), amely a reakcióhő körülményeitől függ, amelyben előfordul. Az izochor állapotváltozás V = const, DV = 0, ezért, a hő a reakció QV változás belső energia a rendszer:
Entalpia, valamint a belső energia egy állami funkció a rendszer.
A reakciók során csak szilárd anyagok és folyadékok, p · DV távú egyenletben (4.10a) elhanyagolható, vagy zéró. Az ilyen reakciók viszonyát DH »DU. Gázfázisú reakciók zajlanak részvételével gáznemű anyagok térfogata jelentősen változik. Ha DV> 0; van egy tágulási, a DH> DU; ha DV <0, т.е. происходит сжатие, то DH ahol Dn - változó móljainak a száma a gáz, a következő egyenletből meghatározzuk a reakció; például, Kémiai reakcióba az hőfelszabadulással nevezzük exoterm. Az izochor állapotváltozás a belső energia a rendszer csökken, azaz DU <0 (т.к. U2 Ábra. 4. 2. Az változás entalpiája rendszer: a) exoterm; b) endoterm reakciók. Fellépő kémiai reakciókkal hőabszorpcióval nevezzük endoterm. Az izochor állapotváltozás DU> 0, az izobár folyamatban - DH> 0. A csökkenés entalpia az exoterm folyamatok, hogy a teljes energia, amely a reakciótermékek formájában energiát a kémiai kötések, intermolekuláris kölcsönhatások, molekuláris rezgések stb kevesebb, mint a teljes energia a kiindulási anyagokkal (reaktánsokkal). Fordítva, a növekedés az entalpia az endoterm folyamatok azt jelenti, hogy a teljes energia, amely nagyobb, mint a teljes energia a kiindulási anyagok a reakciótermékek. A entalpiaváltozást standard állapotban az anyag. a reakcióban részt vevő vagy alatt a fázisátalakulás, jelöljük DH ° (T) és a DH ° (298 K), ha a rendszer hőmérséklete T vagy 298,15 K. Standard képződési entalpia nem csak attól függ a körülmények (hőmérséklet, nyomás, térfogat), amelyben előfordulnak, hanem a számos anyag vesz részt a reakcióban, és azok fizikai állapot. Ezért, annak érdekében, hogy össze lehessen hasonlítani a hatások a különböző energia folyamatok jellemzik őket változtatni entalpia standard körülmények között megfelel egy specifikus kémiai reakció egyenletet. Egyenletek kémiai reakciók, amelyek a hőhatás és aggregációs állapotokat (Z-gáz, a vonat folyadék a kristályos, T-szilárd) vagy allotropic módosítása (például, egy kéntartalmú, b-kén) anyagok, az úgynevezett termokémiai reakció egyenletek . Például: 4.4.2. Termokémiai TÖRVÉNYEK. termokémiai Számítások A hőhatás a kémiai reakciók között meghatározható kísérletesen vagy számítással. Mérése hőhatás hívják kalorimetria. Az alapja a termokémiai számítások a törvény által megfogalmazott orosz tudós, GI Hess (1840):Kapcsolódó cikkek