Részletes mechanizmusa önszerveződés homogén reakcióban Belousov
Érdeklődést # xa0; kémiai rezgések határozzák meg a remény, hogy megértsék a mechanizmus periodikus biológiai folyamatokat.
A probléma az # xa0; az, hogy ma már nincs kielégítő matematikai modell ezeket a változatokat, kísérletileg vizsgálták eléggé.
E papír # xa0; - részletesen a mechanizmus a ön-oszcilláló homogén kémiai reakció Belouszov- Jabotinsky (a B-F), a # xa0; hengeres üveg és # xa0; Petri-csészébe. E cél elérése érdekében az elméleti alapjait az önálló oszcilláló kémiai reakciók vizsgálták; A reakciókat a B-F # xa0; hengeres üveg és # xa0; Petri-csészébe; tanulmányozta a mechanizmus a ön-oszcilláló reakciók B-F, ön-oszcilláló áramkör van kialakítva reakciók B-F.
A sokoldalúság a nemlineáris dinamika fontossá teszi, hogy egy jó választás a laboratóriumi rendszerek # xa0; amely lehet tanulmányozni a szerkezet kialakulását (önszerveződés). A # xa0; ilyen laboratóriumi rendszerek közé tartoznak ön-oszcilláló homogén kémiai reakció, nyitott # xa0; B. # xa0; AP # xa0; Belousov és # xa0; később tanult # xa0; A. # xa0; M. # xa0; Jabotinsky és # xa0, más tudósok.
Belouszov- Zsabotyinszkij reakció # xa0; - ez zajlik a # xa0; ön-oszcilláló módban katalitikus oxidáció redukáló brómsav NVrO3. Így megfigyelhető ingadozások oxidált és # xa0 koncentrációk, redukált formái a katalizátor és a # xa0; Egyes közbenső. A reakció # xa0; savas közegben (H2SO4), a # xa0; ionokat katalizátorként alkalmazott változó oxidációs állapotban cérium Ce (SO4) 2: Ce3 + és # xa0; Ce4 +. A # xa0; szerepet citromsavat működik, mint egy redukálószerrel ((HOOC) C (OH) (CH 2COOH) 2).
reagenseket alkalmaztuk a kísérletben:
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; 160 mg citromsav (HOOC) C (OH) (CH 2COOH) 2 # xa0; - redukálószer;
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; 3 mg kénsav (H2SO4) # xa0; - létrehozásához savas környezetet;
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; 16 g kálium-bromát (KBrO3) # xa0; - szervetlen vegyület, egy sója kálium, alkálifém-és # xa0; brómsav, színtelen kristályok, könnyen oldódik # xa0; vizet, erős oxidálószer is, lehet használni a # xa0; a sütőpor ( egyes országokban tilos) # xa0 - egy élelmiszer-adalékanyag E924; kálium-bromát termikusan instabil, olvadás nélkül bomlik, amely egy bromidot és # xa0; oxigént. Ez reagál # xa0; kénsavat;
# xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; 3,5g cérium-szulfát (Ce (SO4) 2) # xa0; - fehér por, vízmentes só. Ion cérium-szulfát [Ce (SO4) 24+] egy erős oxidálószer, különösen a # xa0; savas közegben. cérium-szulfátot használunk katalizátorként.
A kísérletet a következőképpen zajlott: az elektronikus mérleg 16 g adagolunk # xa0; kálium-bromát (KBrO3) és 3,5 g # xa0; cérium-szulfát (Ce (SO4) 2). Elkészített oldatát kénsav H2SO4 # xa0; aránya 1/3 desztillált víz, citromsav oldattal: egy # xa0; főzőpohárba 60 g # xa0; citromsavat összekeverünk 100 ml desztillált vízben. Ezután, a # xa0; lombikban kálium-bromát és # xa0; cérium-szulfát # xa0; savak (1. ábra).

Ábra. 1. oldatok előállítása citromsav (HOOC) C (OH) (CH 2COOH) 2 (bal) és a # xa0; kénsav H2SO4 (középen) sav, a reagensek elegyítését a # xa0; savak (jobbra)
- # Xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; # xa0; Detailing homogén önrezgő reakciók B-F # xa0; hengeres üveg
Azokban a kísérletekben, # xa0; hengeres üveg rögzített periodikus változását a spektrális emisszió az oldat színe a tejszerű (maximális koncentráció [Ce + 3]) a # xa0; sötét narancssárga (maximális koncentráció [Ce + 4]) és a # xa0; vissza által okozott koncentrációk és rezgések oxidált # xa0; redukált formáját a katalizátor Ce (SO4) 2 és # xa0; intermedierek [Br-] (2. ábra):

Ábra. 2. lépés A reakciót Belouszov- Zhabotinskii (átlagos értékek jelennek):
1 # xa0 - sárga (hullámhossz, λ = 580 nm-nél; frekvencia, f = 520 THz; fotonenergia E = 2,15 eV)
2-narancssárga fény (hullámhossz, λ = 590 nm-nél; frekvencia, f = 510 THz; energia E = 2,10 eV)
3 # xa0; - narancs (hullámhossz, λ = 620 nm-nél; frekvencia, f = 490 THz; fotonenergia E = 1,98 eV)
4 # xa0; - piros (hullámhossz, λ = 750 nm-nél; frekvencia, f = 410 THz; fotonenergia E = 1,68 eV)
Az átmenet a 1. lépésben # xa0; 3. lépés kísérte megjelenése kettéágazódásainak # xa0; - változó állandósult állapotban a rendszer # xa0; egyes pontok Bifurkációk # xa0; - pontok a rendszerben a kritikus állapotban, a # xa0; amelyben a rendszer instabillá válik tekintetében ingadozások és # xa0, van bizonytalanság: ez kaotikus vagy hogy az állam a rendszer költözik egy új, differenciáltabb és # xa0; magas szintű sorrendben. Bár a reakció-komponensek nem költött egy ilyen átmenet bekövetkezik. Stochasticity a # xa0; ebben az esetben tartalmazza a # xa0; valószínűségét a bifurkációs pontokat.
A megfigyelt kémiai reakció exoterm reakció, kíséri hőfelszabadulás miatt a törés a kötvények, kötés kialakulásához vezető reakciót termékek, amely befolyásolja a spektrális emisszió az oldat színe, és a # xa0 jelentése a fotonenergia csökken 2,15eV 1,68 eV.
Rezgési periódus T # Xa0; egyértelműen két részre oszlik: T1 # Xa0; - fázisú katalitikus oxidációs fázis vagy koncentrációjának növelésére [Ce4 +] 1. lépés -4 -3. és # xa0; T2 # Xa0; - a katalizátor redukálására fázis vagy fázis koncentrációja beesési [Ce4 +] 4. lépés -2 -1. Ez történt a # xa0; használó kísérleti adatokkal. Megjegyezzük, hogy T # Xa0; idővel csökkent 1,5-0,6 perc (ris.3-4). Miután valamennyi komponenst költöttek, a reakció leáll.
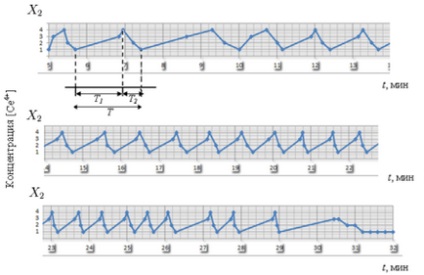
Ábra. 3. A rezgési periódus T # Xa0; reakciók B-F, amely két részre oszlik: T1 # Xa0; - növekedési fázisban [Ce4 +] és # xa0; T2 # Xa0; - fázisú csepp [Ce4 +]
A kapott grafikon mutatja a exponenciális viselkedést a katalizátor koncentrációt.
Az így kapott minta modell megfelel tálcák # xa0; - Volterra # xa0, ahol a koncentráció a C # Xa0; változik exponenciálisan, és # xa0; koncentrációja [Br -] # xa0; - lineáris:
ahol: autokatalizátor koncentrációja [Ce + 3];
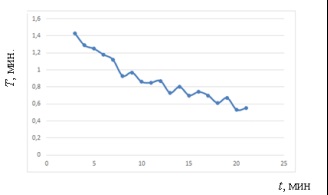
Ábra. 4. Állítsa a T periódus # Xa0; a kísérlet során
Menetrend változás T periódus # Xa0; bizonyítja azonosítása minták # xa0 - időtartamának csökkentése egyenetlen a kísérlet során.
Ábrák vázlatosan egy önrezgő mechanizmusa homogén reakciók B-F # xa0; hengeres üveg (5. ábra):
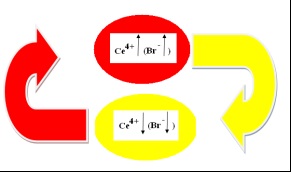
Ábra. 5. A mechanizmus a homogén reakciók B-F autooscillatory
Az első reakciólépésben (piros ovális, T1) [Ce + 3] oxidáljuk bromát. Koncentráció [Ce4 +] növekszik:
Amikor a felső küszöbértéket a koncentráció [Ce4 +] koncentráció (inhibitor) meredeken növekszik, ami a # xa0; inhibíciós reakció. [] Reagáltatjuk # xa0; aktív részecskék és a reakció # xa0; néhány sebességgel eltűnik a rendszerből, amely segít csökkenteni a koncentráció [Ce4 +].
Koncentráció [Ce4 +] csökken (sárga ovális) eléri az alsó küszöbértéket, ahol a koncentrációja [] csökken. Miután az inhibitor koncentrációja [] csökkent, a reakció kezdődik # xa0; nagy sebességű: kinyerjük citromsav tetravalens cérium (HOOC) C (OH) (CH 2COOH) 2-ecetsav:
Ezt követően a ciklus ismétlődik. Így már azonosított „óra” reakciók: [].
A hátránya a javasolt rendszer, hogy egyrészt nem tartalmaz # xa0, az összes kémiai folyamatok és # xa0; kiosztja csak két fő, és a # xa0, másodszor nem tartalmaz olyan matematikai modell oszcilláció mintákat.
A kísérlet # xa0; Petri-csészébe előállított oldat # xa0 használtunk; előző kísérletben, amelyet került egy vékony réteg.
Van egy auto-hullám folyamat, eredő diszperziója a katalizátor koncentrációja a felület egyenetlenségeitől.
Ezt a folyamatot az jellemzi, auto-hullám térbeli és # xa0; időbeli dimenziók, független a kezdeti feltételek és a # xa0; geometriai méretei a rendszer.
Azt is látta a változást a spektrális emisszió a sárga és a # xa0; narancs, okozta ingadozások a koncentráció a katalizátor Ce (SO4) 2 és # xa0; intermedierek a sárga és narancssárga (6. ábra). Koncentráció változtatása [Ce + 3] és [Ce4 +] nem fordul elő szinkronban az egész oldatot miatt a ferde ingadozások # xa0; egyes pontok oldatot maximumokat egyenlőtlenül # xa0; különböző részein az oldatot.
Így megfigyelhető periodikus oxidációk utazó hullámok származó inhomogenitás (adagban # xa0; módosított paraméterek). A sebesség terjedési állandó, és oxidációs hullámok # xa0; tulajdonságai határozzák meg a tér, és a # xa0; ismétlési periódus # xa0; - paraméterek # xa0; része inhomogenitás.
Ábra. 6. Változások a szerkezet a autowaves # xa0; reakciók B-F # xa0; Petri-csészébe
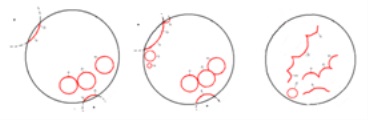
Ábra. 7. sematikus ábrázolása a változás fronton
Amikor ez történik, mivel a helyi szinkronizálás közepes savasság vagy koncentráció bromátion-. Legyen A # xa0; és B # xa0; - savasság (A) és # xa0; növekvő koncentrációjának bromát (B); C # xa0; - ütközési pontja az első hullám A # xa0, és B; D # xa0 - A rögzítés # xa0; hullámok származó A; F # xa0; - teljes eltűnését a fázis oszcillációk (8. ábra).
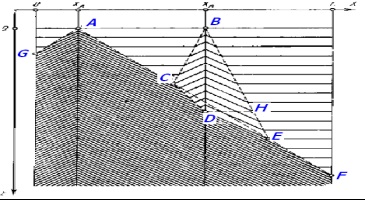
Ábra. 8. Környezet szinkronizálás: az abszorpciós hullám másik
Betöményítés után a reakció komponenseket, és a # xa0, nevezetesen, a koncentráció a azonosított „clock” reakciók: [] óta használják fel, a reakció leáll.
Így, annak ellenére, hogy a különböző feltételek áramlási kísérlet # xa0; hengeres es főzőpohárba, és # xa0; Petri-csészébe: a # xa0; első esetben okozhatja a kezdete önszerveződés folyamat bifurkációk, a második # xa0; - szórása a katalizátor koncentrációja a felület egyenetlenségeitől a # xa0; mindkét esetben észlelt „óra” reakciók: [] # xa0 - bróm ionok jelenlétében a kívánt értéket, amely a fő, de nem az egyetlen feltétele a dob önszerveződés. A # xa0; tálcán „vadász-zsákmány” ezek a „clock” a takarmány az áldozat, ha a takarmány nem elég # xa0 - juh meghal, és meghal # xa0 farkasok. Ha a takarmány nagyon sok # xa0 - Wolves túltelített, stop vadászat # xa0; falkájukat hierarchiában fog cserélni törvények ... T. # xa0 e. van egy egyetemes törvényei önszerveződés!
Alapvető kifejezések (automatikusan generált). es főzőpohárba, és Petri-csészében, egy hengeres csésze és csésze reakciók B-F, ön-oszcilláló reakciók B-F, szulfát cérium, a katalizátor koncentrációjától, a reakció komponenseket, kémiai reakció, citromsav, oxidációs katalizátor fázis reakciók B-F egy hengeres, a kálium és a cérium-szulfát, a reakció mechanizmusa egy önrezgő, T1 - fázis, és T2 - fázisú, kálium-bromát, növekedési fázisban, a csökkenő fázis, koncentráció növekedése fázis, fázis koncentrációja csepp.