Cikláz messendzhernaya rendszer
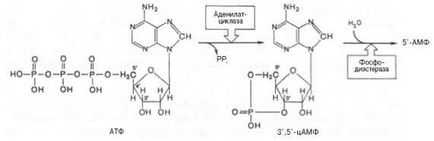
A leginkább tanulmányozott cAMP-függő útvonal hormonális jelátvitelt. Ez magában foglalta mimimum öt jól tanulmányozott fehérjék. 1) hormon receptor; 2) az enzim adenilát-cikláz. funkciója van szintézisét ciklikus AMP (cAMP); 3) G-fehérje közötti kommunikáció a receptor és az adenilát ciklázt; 4) cAMP-függő protein kináz. foszforiiációját katalizálja intracelluláris enzimek vagy célfehérjék, megváltoztatják azok aktivitását, illetve; 5) foszfodiészteráz. amelynek hatására a cAMP lebontását, és ezáltal leáll (megszakítások) a jel (ábra. 8.5).
Kapunk tiszta formában # 945; - és # 946; adrenerg receptorok a plazmamembrán májsejtek. izom- és zsírszövetben. Kimutatták, hogy kötődése hormon # 946; adrenerg receptor vezet strukturális változások az intracelluláris domént a receptor. amely viszont biztosítja a receptor kölcsönhatás egy második fehérje jelátviteli - GTP-kötő.
GTP-kötő fehérje - a G-fehérje - egy keveréke két típusú fehérjéket. aktív Gs (az angol. stimuláló G) és gátló Gi mol. súly 80000-90000. Ennek részeként mindegyikük, három különböző alegységek (# 945, -, # 946; - és ;-) # 947, azaz ez heterotrimerek. Az eredmények azt mutatják, hogy a # 946; -subedi-Nica Gs és Gi azonos (molekulatömeg 35.000.); egyszerre # 945; alegység, amelyek olyan termékek különböző gének (., Mol tömeg 45,000 és 41,000) bizonyult felelős megnyilvánulása a G-fehérje aktivátor és a gátló aktivitást, ill. Gormonretseptorny komplex jelentéseket a G-protein azon képességét, nem csak könnyű kicserélni kötött GDP endogén GTP, hanem lefordítani -belok Gs az aktivált állapotban, ahol az aktív G-protein jelenlétében disszociál Mg 2+ ionok # 946; -, # 947; alegység és komplex # 945; alegységét Gs a GTP formájában; Ez az aktív komplexet ezután átvitelre és aktiválja az adenilát-ciklázt a molekulában. A komplexet ezután vetjük alá öninaktiváción által az energia a GTP és az összeomlás újracsatlakozási # 946; - és # 947; alegységek alkotnak az eredeti GDF-forma Gs.
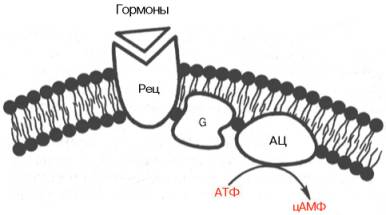
Ábra. 8.5. Camp-függő útvonalat hormonális jelátvitel.
Retz - receptor; G - a G-protein; AC-adenilciklázban.
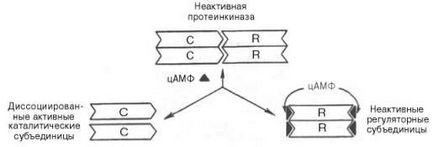
A protein-kináz - egy intracelluláris enzim. amelyen keresztül a cAMP észre a hatását. A protein-kináz lehet két formában. Hiányában cAMP proteinkináz képviselteti magát, mint tetramer komplex, amely a két katalizátor (C2), és két szabályozó (R2) alegységek molekuláris. tömegek a 49000 és 38000 volt; formájában az enzim aktivitását. Jelenlétében cAMP proteinkináz komplex reverzibilisen disszociál egyik R2 alegységet és két szabad katalitikus alegység C; ez utóbbi enzimatikus aktivitással. katalizálni foszforilációja fehérjék és enzimek. ennek megfelelően megváltoztatja a celluláris aktivitást.
Meg kell jegyezni, hogy egy nagy osztálya nyitott sejtek cAMP-függőség Mykh protein kinázok. fenti protein kinázok A; katalizálja az egy foszfát csoport OH-csoport a szerin és treonin (az úgynevezett szerin-treonin kinázok). Egy másik osztálya a protein-kinázok. különösen aktivált inzulin receptor (lásd. a korábbi), hat csak a tirozin OH-csoportján. Azonban, minden esetben a mellett egy erősen töltött foszfátcsoportokat, és a hangerő nem csak konformációs változást okoz a foszforilált fehérjék. de a változás az aktivitásuk vagy kinetikai tulajdonságait.
A aktivitását számos enzim szabályozza a cAMP-függő foszfo-rilirovaniem, illetve a legtöbb hormon protein-peptid aktiválja a folyamatot. Azonban, számos hormon fejt ki gátló hatással bírnak az adenilát-ciklázt. -kal csökkenti a cAMP szintjét és a fehérjék foszforilezésével. Különösen, a hormon szomatosztatin. összekötő annak specifikus receptor - gátló G-fehérje (Gi, amely egy strukturális homológja Gs -fehérje (lásd korábban) ingibi-RUET adenilát-cikláz és a cAMP-szintézis, hogy okoz hatása ellentétes az a hívott adrenalin és a glukagon számos szervek .... prosztaglandinok (különösen RGE1) is gátló hatást fejtenek ki az adenilát-ciklázt. jóllehet ugyanazt a szervet (a sejttípustól függően), és ugyanaz a aktiválhatja PGE-1 cAMP-szintézist.
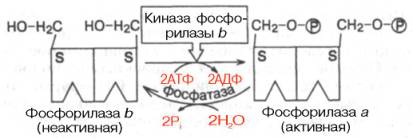
A részletes tanulmány az aktiválási mechanizmusa és szabályozása izom glikogén. aktiváló glikogén lebontását. Kiosztani 2 formák: egy katalitikusan aktív - és inaktív fosforilazaa - foszfo-rilaza b. Mindkét foszforiláz épített két azonos alegységből (mol. Súly 94.500) minden szerin maradékot 14-es helyzetben van kitéve foszforiláció-defoszforiláció folyamat, az aktiválási és inaktiválási, illetőleg (ábra. 8.6).
Az intézkedés alapján foszforiláz kináz b, amelynek aktivitása szabályozza a cAMP-függő protein-kináz. Mindkét alegységen a molekula inaktív formája foszforiláz b alávetni kovalens foszforiláció-vaniyu és kapcsolja be az aktív foszforiláz egy. Defoszforiiációs az utóbbi hatása alatt egy specifikus foszfatáz és foszforiláz vezet enzim inaktiválása, és térjen vissza az eredeti állapotába.
3 típusú szabályozás látható glikogén az izomszövetek. Az első típus - kovalens alapuló szabályozás hormon-foszforiláció-defoszforiláció foszforiláz alegységek (lásd 8.6 ábra ..).
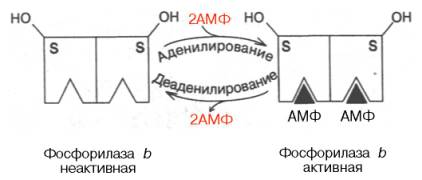
A második típus - allosztérikus szabályozás. Ez alapján a reakciók az adenilezési dezadenilezési-alegységének glikogén foszforiláz b (rendre az aktiváló-inaktiváló). Reakciók által meghatározott irányban koncentrációjának aránya az AMP és az ATP. Nem csatlakozik az aktív centrum. és a alloszterikus központ minden alegység (ábra. 8.7).
A dolgozó izmok cAMP felszaporodása. köszönhető, hogy a hulladék az ATP. poliadenilezésí és aktiválását okozza foszforiláz b. Nyugalmi, éppen ellenkezőleg, magas ATP-koncentráció. kiszorítja AMP. vezetnek allosteriche-ég Az enzim gátlása által dezadenilezési.
cAMP és a protein kináz központi szerepet játszanak a hormonális szabályozásában a glikogén szintézis és lebontás a májban (ábra. 8.8). Részletek a kémiai reakciók glikogén lásd fickó. 10.
A harmadik típus - kalcium szabályozásban alapuló alloszterikus aktiválása foszforiláz kináz B Ca 2+ ionok. amelynek koncentrációja emelkedik során izomösszehúzódás, és ezzel hozzájárul a formáció az aktív foszforiláz egy.
