Típusai a reaktív részecskék és a reakció mechanizmusok a szerves kémiában
Hypermarket ismeretek >> Kémia >> Kémia >> Kémia Grade 10: típusai a reaktív részecskék és a reakció mechanizmusok a szerves kémiában.
A legjellemzőbb a szerves vegyületek kovalens kötés jön létre az átfedés atomi pályák és képződését elektron párok közös. Ez azt eredményezi, összesen két orbitális atomok, amely megosztott elektronpárt. Nyúlás kapcsolat közös sorsa ezeknek elektronok eltérő lehet.
Kicserélődési mechanizmusát kovalens kötés kialakulását. Homolitikus kötés hasítása
Orbital egy párosítatlan elektront tartozó egyik atom átfedés lehet az orbitális másik atom, amely szintén egy páratlan elektron. Ebben az esetben, a kovalens kötés alakul ki a csere mechanizmus:
· + H · H -> N. H vagy H-H
Az árak a kovalens kötés kialakulásának mechanizmusa realizálható, amikor a teljes elektronpár képződik a párosítatlan elektronok tartozó különböző atomot.
Process ellenkező kovalens kötés kialakulását a csere mechanizmus egy kommunikációs rést, amelyen minden egyes atom eltér egy elektron. Ennek eredményeként, a két töltés nélküli részecskék kialakítva; párosítatlan elektront:
Az ilyen részecskék, úgynevezett szabad gyökök.
A szabad gyökök - atomok vagy atomcsoportok, amelyek páratlan elektront.
Mechanizmus kovalens kötés hasítása, amelynél szabad gyökök képződnek, nevezzük a hemolitikus vagy homolízissel (homo - .. ugyanaz, vagyis olyan típusú kötés hasítása képződését eredményezi a hasonló részecskék).
A reakciók zajlanak hatása alatt és a részvétel a szabad gyökök nevezik szabadgyök reakciók.
Ennek során a szervetlen kémia már találkozott ezekkel a folyamatokkal. Ez a reakció a hidrogén és oxigén, a halogének, az égési reakció. Felhívjuk figyelmét, hogy ez a fajta reakció jellemzi a nagy sebességű, megjelenése nagy mennyiségű hőt. Az okok ezek a jelenségek, valamint a mechanizmus maga reakciók specifikus szerves vegyületek, nézzük meg később.
Donor-akceptor mechanizmusa kovalens kötés kialakulását. Heterolitikus kötés hasítása
A kovalens kötés lehet kialakítva, és egy donor-akceptor távú mechanizmusát. Az egyik atom pályák (vagy anion), amelyen a nem megosztott elektronpár átfedésben van egy másik üres orbitális egy atom (vagy kation), amelynek töltetlen orbitális, ezáltal kovalens kötés, például:
Donor-akceptor kovalens kötés kialakulásának mechanizmusa realizálható, amikor a teljes elektronpár kialakítva egy osztatlan elektronpárt az egyik atom - donor. A második atom akceptor kell biztosítani kitöltetlen orbitális.
Módszer kovalens kötés hasítása, fordított annak kialakulása egy donor-akceptor mechanizmus - heterolitikus vagy n-teroliz, képződéséhez vezet a pozitív és negatív töltésű részecskék, mivel ebben az esetben mind az elektronokat az összes elektronpár marad az egyik atom a másik betöltetlen pályák az atom kapjuk:
Már ismerjük a tanfolyam Szervetlen Kémiai heterolízis esetben elektrolitos disszociáció savak:
Ez könnyen kitalálható, hogy a részecske egy magányos elektronpár R: -. t. e. a negatív töltésű ion, is vonzza a pozitív töltésű atomok vagy atomok, amelyben van legalább egy részleges pozitív töltést vagy hatékony. Részecskék lone elektronpár nevezzük nukleofil ágensek (nucleus - a mag egy pozitív töltésű része atom), azaz, „barátok” nucleus pozitív töltés ...
Nukleofil (Nu) - anionokkal vagy molekulák nepode Fief-elektronpár, hogy kölcsönhatásba lépnek területek molekulák, amelyben a tényleges pozitív töltés bepároljuk.
Példák a nukleofil: Cl - (klorid anion) OH - (hidroxid anion) SN3O - (metoxid anion), CH3COO - (acetát anion).
Részecskék töltetlen pályák, ezzel szemben, hajlamosak, hogy töltse meg, és ezért is vonzza a részeit molekulák ahol van egy nagyobb elektronsűrűség, negatív töltésű, magános elektronpárt. Ezek elektrofilek, „barátok” elektronok vagy negatív töltés részecskék fokozott elektronsűrűség.
Elektrofilek - kationokkal vagy molekulák, amelyek a kitöltetlen elektron pályák célja elektronok, hogy töltse meg, mert ez vezet a jövedelmezőbb e-atom konfigurációja.
Nem minden részecske egy kitöltetlen orbitális az elektrofil. Így például, az alkálifém kationok vannak konfigurálva inert gázok, és nem hajlamosak megszerezni elektronok, mert van egy alacsony elektronaffinitás. Ebből arra lehet következtetni, hogy annak ellenére, hogy volt egy kitöltetlen pályák, mint a részecskék nem lesz elektrofil.
A kölcsönösen befolyásolják egymást az atomok a molekulák a szerves vegyületek
Az egyik legfontosabb rendelkezései az elmélet a szerkezetét szerves vegyületek, AM Butlerov az a helyzetben, hogy a tulajdonságok az atom egy molekula határozza meg nem csak a természet, hanem annak közvetlen környezetében.
Mielőtt elkezdjük nézi a mechanizmusok reakciók szerves vegyületek, meg kell vizsgálni a lényege a kölcsönös hatása atomok és csoportok az atomok szerves vegyületek.
Induktív effektus. Tekintsük a eloszlása elektronsűrűség a molekulában a bróm-metán CH 3 Br. C-Br kötés a molekula poláris bróm-metán. Emlékezzünk, hogy a kapcsolat polaritását az határozza meg elektronegativitása atomok kémiai elemek, m. E. vonzó képességüket elektronokat a kialakulása egy kémiai kötés.
Bróm elektronegativitási nagyobb, mint a szén, és a kapott brómatom van kialakítva részlegesen negatív töltéssel TH, és a szénatom - részleges pozitív töltést Þ +. elektron mentén való elmozdulását C-Br lehet megjeleníteni két módon - vagy megadásával részleges díjat az atomok, vagy a nyíl kötés mentén.
CH Þ + -Br TH CH3 -> Br
Az elmozdulás az elektronikus kommunikációs sűrűség miatt bekövetkező eltérő electronegativities az atomok és atomcsoportok érintő nevezett indukciós hatása (I).
Azt mondjuk, hogy az atom egy nagyobb eiektronegativitás vonzza az elektronokat, negatív akceptor (elfogadni - kapni) hatás, amely jelöli -I.
Mi is eredményezheti I-hatás brómot?
A halogénatom a molekulában halogén-alkánban (bróm brommetane) könnyen helyettesíthető egy hidroxil anion hatására lúgos vizes oldatban.
Hidroxil anion vonzódik a szénatom (szénatom támadások), amely elsősorban egy parciális pozitív töltéssel rendelkezik, és helyettesíti a bróm, pontosabban, a bromid anion.
A molekula 1-klór-propán elektronpár a szén-klór kötés felé elő van feszítve egy klóratom, mert a nagyobb elektronegativitása. Ebben az esetben a szénatom hogy parciális pozitív töltéssel (§ +), húzza elektronok a társított szénatom. hogy viszont a következő:
Így az indukciós hatás végigmegy a lánc, de gyorsan halványul: ez gyakorlatilag nem figyelhető meg a három művészeti kommunikáció.
Tekintsünk egy másik reakció - összekötő hidrogén-bromid és etén:
CH2 = CH2 + HBr -> CH3 SN2Vr
A kezdeti szakaszban a reakció bekövetkezik csatlakozás hidrogén kation tartalmazó molekula többszörös kötés:
CH2 = CH2 + H + -> CH 2-CH 3
Elektronok l-tolódott miatt ugyanazt szénatomjával szomszédos fordult pozitív töltés töltetlen pályák.
Stabilitás Ezen részecskék határozza meg, milyen jól kompenzálja a pozitív töltés a szénatomon. Ez a kompenzáció miatt előfordul, hogy az elmozdulás az elektron sűrűség és a felé mutató kötés pozitív töltésű szénatom, azaz. E. Pozitív induktív hatás (1).
Csoport atomok, ebben az esetben egy metil-csoport, amelyből a elektronsűrűség van húzva, a donor van hatása, hogy jelöljük +1.
Mezomorf hatást. Van egy másik módja, hogy befolyásolja bizonyos atomok vagy csoportok más - mezomer hatása, vagy egy kapcsolószer hatást.
Tekintsünk egy molekula 1,3-butadién:
Kiderült, hogy a kettős kötések a molekula - ez nem csak két kettős kötést! Mivel ezek a szomszédos, egymást átfedő történik igénypont -kötéseken tartalmazza a szomszédos helyzetű kettős és úgy van kialakítva közös mind a négy szénatom n -electron felhő. A rendszer (molekula) stabilabb lesz. Ez a jelenség a konjugáció (ebben az esetben n - N-konjugát).
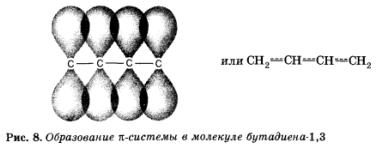
További átfedés, l-pár, elválasztott kötések egy O-kötést, vezet, hogy a „átlagolja”. Központi egyszerű összefüggést szerez részleges „kettős” karakter erősebb lesz, és rövidebb, és a kettős - több gyengül, és megnyúlnak.
Egy másik példa a hatása konjugálása a kettős kötést olyan atommal, amelynek egy nem megosztott elektronpárt.
Például, ha a karbonsav disszociációs marad osztatlan elektronpárt egy oxigénatom:
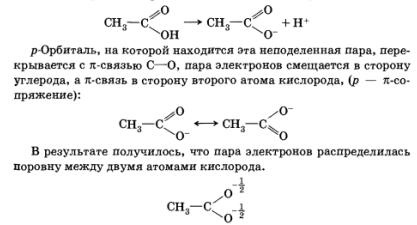
Ez növeli a stabilitást a anion során képződött disszociációs, növekvő sav erőssége.
Az elmozdulás a elektronsűrűség a konjugált rendszer bevonásával p-kötést vagy magános elektronpár nevezett mezomer hatástól (M).
Az alapvető mechanizmusának reakciók
Van azonosított három alaptípusa reaktív részecskék - szabad gyökök, elektrofilek, nukleofilek és három megfelelő típusú reakció mechanizmusok:
• szabad gyök;
• elektrofil;
• nukleofil.
Továbbá a jelzési reakció típusának megfelelően a reagáló fajok szerves kémiában megkülönböztetni négyféle reakciók elvén összetételének megváltoztatásával molekulák: addíció, szubsztitúció, elimináció, vagy megszüntetését (. Angol, hogy megszüntesse - törölni, hasított) és átrendeződés. Mivel az adagolás és a helyettesítési kerülhet sor hatására mindhárom, akik képesek reaktsionnospo részecskék, számos alapvető reakciók áramlási mechanizmusokat.
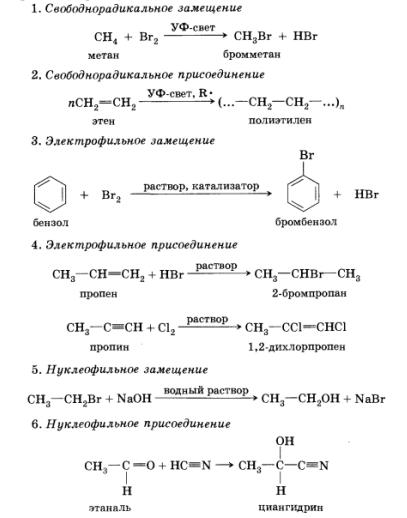
Ezen felül, akkor nézd meg a hasítási reakció, vagy megszüntetése, melyek hatása alatt nukleofil faj - alapon.
Azt feltételezhetjük, hogy ebben a reakcióban, a hidrogén-bromid hasad le egy molekula 2-bróm-etán-molekula. Jelenlétében alkáli- és keletkezett nátrium-bromidot vízzel.
1. Mi az homolitikus és heterolitiku szünetek kovalens kötés? Melyik mechanizmusok kovalens kötés, azok jellemző?
2. Mi a neve, elektrofil és nukleofil? Adj nekik példát.
3. Mi a különbség az induktív és mezomorf hatást? Mivel ezek a jelenségek a helyzetét szemléltetik az elmélet a szerkezetét szerves vegyületek, AM Butlerov a kölcsönös befolyás az atomok a molekulák a szerves anyagok?
4. Tekintettel az induktív és mezomer hatása, úgy a kölcsönös befolyás az atomok molekulák:
Erősítse megállapításaikat példákat egyenletek a kémiai reakciókat.
Ha javításokat és javaslatokat a leckét, kérjük lépjen kapcsolatba velünk.
Ha azt szeretnénk, hogy a többi beállítást és javaslatokat órák, nézd meg itt - Oktatási fórum.