Szilícium van a kémiai elem
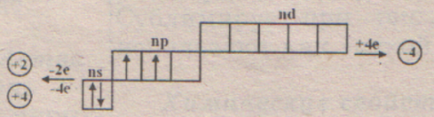
A külső réteg 4 elektron réteg nem teljes, de tele van a fele. Szilícium-atom sugara nagyobb, mint a szén, a vegyérték elektronok távolabb a mag, mint a szénatomon => EO alacsony; Silicon - a nemfém, de szokatlan. Az alapállapotú hogy két páratlan elektronnal, de a vegyérték szilícium vegyületekben II nem mutat. A jelenlévő szabad p-pályák lehetővé teszi az S-átmenet egy elektron, és a megjelenése négy páratlan e -. és => jellemző vegyértékű neki - (IV). A lehetséges negatív sd -4, ez nyilvánul vegyületek fémekkel - szilicidek. De hivatalosan. A valóságban sok ilyen változó, és nem felel meg a szokásos oxidációs állapotok. A tananyag öngyilkosságok nem vizsgálták. Minden vegyületek nem fémek szilícium van egy +4 oxidációs állapotban van. A legegyszerűbb LAN - szilán SiN4. nagyon instabil. A
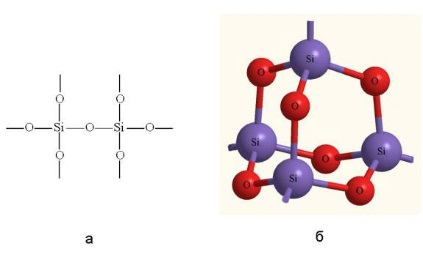
Itt -oxid SiO2 és az összes sói kovasav - éppen ellenkezőleg, nagyon stabil vegyületek.
Eloszlás a természetben: a szilícium-körülbelül 28 tömeg% a kéreg, vagyis elterjedni a világon a második csak oxigén. Ez akkor fordul elő csak a formájában különböző oxigéntartalmú vegyületek - és a szilikátok. A földkéreg áll több mint a fele, mert ezek a vegyületek. Ez azzal magyarázható, hogy az a szilícium atomok alkotó különösen erős kötést oxigénnel.
8. Egyszerű anyag. A szilícium-allotrópia lehető a szén, de grafit-szerű (amorf) módosítása (barna por) rendkívül instabil STP
Diamond-szilícium módosítását. kristályrács - nukleáris, mind a négy kötvények egyenlő, és arra irányul, hogy a csúcsai a tetraéder. Solid finom kristályok sötét szürke színű, fémes csillogású. A természetben nem található. A kristályok tűzálló (1428 ° C), nagyon kemény, de törékeny; Ez nem oldódik vízben. Kristályos szilícium - félvezető, a vezetőképességét jelentősen növekszik megvilágítás hatására vagy fűtés. Vezetőképessége erősen függ a jelenléte bizonyos szennyeződések (például P szennyeződések így p-Si, és hozzáadunk a B nyerjük a P-Si. Silicon széles körben használják, mint egy félvezető mikroelektronika.

Oxidálószerként szilícium reakcióba lép a fémek:
Si + Ca → Ca2 Si (kalcium-szilicid), emelt hőmérsékleten
Redukálószerként, szilícium melegítés hatására reakcióba lép az oxigénnel és más aktív nemfémek, oxidokkal. Ezek a reakciók zajlanak sokkal könnyebben, azaz csökkentve annak tulajdonságait sokkal gyakoribbak, mint oxidációs. Például:
2) Si + C → SiC (szilícium-karbid - átlátszó, nagyon kemény kristályokból áll nagy törésmutatójú és kémiailag ellenálló, mint a gyémánt, vagy egy kristály-alumínium-oxid belőle a dörzspapír és körök, lemez, padló, deszka kemencék).
Szilícium-vegyületek a hidrogén nem lehet ont közvetlenül előállíthatjuk az egyszerű anyagok. Ezek közös név - szilánok. Ezek nagyon illékony, nagyon kellemetlen szaga, könnyen lebomlanak, öngyulladó levegőben.
Megközelítés. A kvarchomokból magas hőmérsékleten szilícium kinyerjük aktív fémeket, vagy koksz. De az ilyen szilikon nem áramot vezessenek, mivel tartalmaz 5-3% szennyeződést. A kapott szilícium-elektronikai tisztítjuk speciális módszereket (zóna olvadás).
1. A szilícium egykristály megfelelő adalékanyagokat használnak gyártásához napelemek (napelemek és mások ...), diódák és tranzisztorok (erősítők és egyenirányítók elektromos készülékek). 2. A kohászati szilícium használt „dezoxidáló” Acélok és kölcsönöz fokozott korrózióállóságot.
9. A szilícium-vegyületek negatív oxidációt. Szilicidek (szilícium-vegyület aktív fémeket) előállítására használják hőálló és saválló ötvözetek, magas hőmérsékletű félvezető anyagok.
10. Sokkal gyakoribb a természetben, és a termelés foglalkozunk oxigénnel szilikon vegyületek, amelyekben van egy erős pozitív oxidációs állapotú.


Egy különleges fajta kvarc gyújtani. ásványképződés álló kristályos és amorf szilícium-dioxid (SiO 2) az üledékes kőzetek. Gyakran színezett vas- és mangán különböző színekben. Ez átlátszatlan, nagyon kemény rock, amely egy éles zseton. Az ókori ember használta a tűz, és eszközöket.
kvarckristályok van egy nagy törésmutatójú, ultraibolya sugárzás át, így azok használják az optikai eszközök. Közülük gyakran készült ékszerek, utánzó (elég sikeresen) gyémánt. Egy még rendelkeznek egykristályok kvarc piezoelektromos hatás (azaz a hatás bekövetkezésének dielektromos polarizáció mellett a mechanikai feszültségek (és fordítva)). Ezt a hatást használják akusztikus eszközök, Piezo öngyújtók és egy mosógép ...
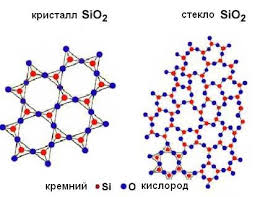
Szilícium-oxid kémiailag inert, vízben oldhatatlan. De kondenzált reagál lúgok, azaz szilícium-dioxid egy savas oxid.
oxidálja aktív fémek magas hőmérsékleten, azaz mutathatnak oxidáló tulajdonságokat. de gyengén:
Mg + SiO2 → MgO + Si
Különleges szilícium-oxid kémiai tulajdonság, hogy képes feloldódni hidrogén-fluorid. Ezt az eljárást alkalmazzák a etch üveg.
1). homok - az építőiparban;
2). homok - gyártásához üveg;
3). homok - gyártásához kerámia (porcelán, cserép, tégla);
4). homok - cement gyártása;
5). egykristályok - a rádiós és elektronikai (erősítők és egyenirányítók, a rögzítő és reprodukáló berendezés), készülékek (ultrahangos eszközök: kolloid malmok, mosógépek, ultrahang, stb);
6). kvarcüveg - optikai és kémiai eszközök
7). amorf formában - például szárítószerek, és adszorbensek.