Kémiai reakció sebességét nevezzük a tényezőket, amelyek befolyásolják az arány a kémiai reakció
= Vegyi reakciók arányát, a változás az anyag mennyiségét az időegység alatt egységnyi reaktor tér-CIÓ
Az átlagos sebessége a reakció:
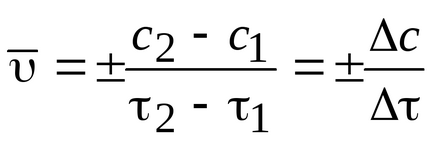
Befolyásoló tényezők a vegyi reakciók arányát. A reakció sebességét úgy határozzuk meg, a következő jelentős tényező oc:
a természet a reaktánsok (az aktiválási energia);
A reaktánsok koncentrációja (a törvény akció-ING tömeg);
hőmérsékleten (általában van't Hoff);
katalizátor jelenlétében (aktiválási energia);
nyomás (elóállíthatók gázok);
a mértéke csiszoló (a reakció előforduló bevonásával szilárd anyagok);
sugárzást nézet (látható, UV, IR, X-ray).
Head-Th a kémiai reakciók sebességének által kifejezett koncentrációja az alaptörvény kémiai kinetika - a tömeghatás törvénye.
18.Sformuliruyte alaptörvényét kémiai kinetika - a tömeghatás törvénye. Mi a reakció sebességi állandója?
Az 1865-ben Prof. N. Beke-nek az első alkalommal előterjesztett azt a hipotézist, a mennyiségi viszonyát a tömegek a reagensek és az idő folyamán a reakció”. at-vontatási a termék aránya a tömeghatás. " Ezt a feltételezést támasztja alá a tömeghatás törvénye, amely-ben alakult, 1867-ben a két norvég kémia kami KM Guldberg és P. Waage. Modern megfogalmazott egységes tömeghatás törvénye a következőképpen: állandó hőmérsékleten a kémiai reakció sebessége egyenesen arányos PRODUCTION Deniyu a reagáló anyagok koncentrációit, hozott fok, egyenlő a sztöchiometriai együtthatók uravnensh reakciót.
A reakció aA + BB = + nN mM kinetikai egyenlet Kona tömeghatás a formája:
ahol

k - arányossági tényező, az úgynevezett con-kémiai reakció sebességi állandók (a
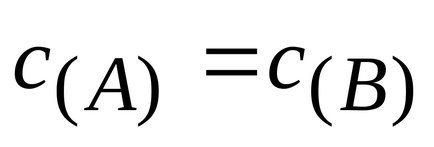

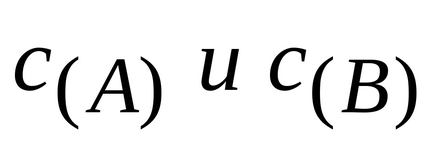
A konstans kémiai reakció sebessége független a con központosítás a reagensek, mint természete határozza meg a reagensek és a reakciókörülmények (hőmérséklet, Nali Chiem-katalizátor). Egy adott reakciót előforduló ilyen körülmények, a sebesség állandó állandó.
19.Pravilo van't Hoff. A hőmérsékleti együttható a reakció sebességét.
A függőség a reakció sebessége a hőmérséklet közelítőleg határozzuk empirikus szabály van't Hof-F: amikor a hőmérséklet-változás minden 10 fokos SKO-Magasság legtöbb reakció változott 2-4 alkalommal.
Matematikailag van't Hoff szabály a következőképpen fejezhető ki:
y-hőmérsékleti együtthatója a reakció sebességét.
Az érték a γ az endoterm reakció magasabb, mint az exo-termikus. Sok γ válaszokat a 2-4 tartományban.
A fizikai értelmében a mennyiség γ abban a tényben rejlik, hogy azt mutatja, hogy hány alkalommal a reakció sebessége változik a hőmérséklet változására minden 10 fok.
Mivel a sebességi állandó a reakciót, és a kémiai reakció sebessége egyenesen arányos a, kifejezés (3.6) gyakran írva a következő formában:
y-hőmérsékleti együtthatója a reakció sebességét.