Tárgy № 1 atomi kristályszerkezete fémek fémek osztályozás
Bizonyos fémek megérteni elemcsoport elrendezve a bal oldali részében Mengyelejev periódusos.
A különlegessége a szerkezete fémes anyagok, hogy megépítésük Elsősorban ilyen atomok, amelyek a külső elektronok gyengén kötött a sejtmagba. Azt is meghatározza a speciális karakter a kémiai kölcsönhatás az fématomok és fém tulajdonságai.
Elmélet fémes állapotban fém álló anyag pozitív töltésű ionok, körül negatív töltésű részecskék - elektronok gyengén kötött a sejtmagba. Ezek az elektronok folyamatosan mozognak belül a fém nem tartoznak az egy és néhány atom, és az összessége atomok.
A jellemző atomi-kristályos fémszerkezet jelenléte az elektron gáz belsejében a fém gyengén kötődik a pozitív töltésű ionok.
Minden fém osztható két nagy csoportra - vas és nem vastartalmú fémek.
A vastartalmú fémek sötétszürke, egy nagy sűrűségű (kivéve az alkáliföldfém), magas olvadáspontú, viszonylag nagy a sűrűsége, és sok esetben polimorfizmust mutatnak. A legjellemzőbb fenti csoportba tartozó fémek a vas.
Szines fémek gyakran jellegzetes szín: piros, sárga, fehér. Van egy magas alakíthatóság, alacsony keménység, viszonylag alacsony olvadáspontú, jellemzi őket a hiánya a polimorfizmus. A legjellemzőbb fém ebben a csoportban a réz.
Tekzhe fémek alábbiak szerint osztjuk fel:
1. Vas fémek - vas, kobalt, nikkel, és közel a őket mangán tulajdonságait. Kobalt, nikkel és a mangán gyakran adalékként felhasznált vasötvözetek, valamint az alapját a megfelelő ötvözetek, hasonló tulajdonságaik, hogy erősen ötvözött acélok.
2. Tűzálló fémek. olvadáspontja amely magasabb, mint a vas (azaz, 1539 C). Használják adalékanyagként olyan ötvözött acél, valamint az alapja a megfelelő ötvözetek.
3. A ritka földfémek (RMZ) - lantán, cérium, neodímium, prazeodímium, stb joinable úgynevezett lantanidák, és azokhoz hasonló tulajdonságok, ittrium és szkandium ..
4. Az alkáliföldfémek a szabad fémes állapotban nem vonatkozik, kivéve a speciális eseteket.
Szines fémek vannak osztva:
1. Könnyű fémek - berillium, magnézium, alumínium, melynek kis sűrűségű.
2. A nemesfémek - ezüst, arany, platina csoportba tartozó fémek.
3. Olvadó fémek - cink, kadmium, higany, ón, ólom, bizmut, tallium, az antimon és elemek legyengült fémes tulajdonságokkal - gallium, germánium.
A kristályos szerkezet fémek
Bármely anyag lehet három állapotban-szilárd, folyékony vagy gáz halmazállapotú.
Kristályos állapotban legfőbb jellemzője az egyedi, szabályos elrendezésben atomokat az űrben.
A kristály, minden atom azonos számú legközelebbi atom - szomszédok található ugyanolyan távolságra is.
A elrendezésben atomokat egy kristály képviseli, mint egy térbeli áramkörök, az úgynevezett kristály sejtek. Kevesebb elemi cella kristály jelenti azt a legkisebb csoport, amely, ha megismételt megismétlését tér lehetővé teszi, hogy reprodukálja a térbeli rács.
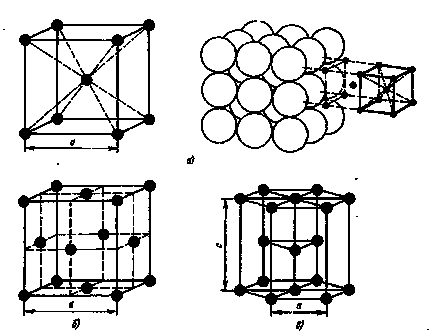
1. ábra. Kristályrács:
és - a test-központú köbös, - egy lapcentrált köbös; hogy - hexagonális szoros illeszkedésű
Aspirációs fématomok elfoglalják a hely, legközelebb egymáshoz, kialakulásához vezet a következő típusú rácsok (1. ábra): tércentrált köbös-mennyiség, lapcentrált köbös és hexagonális szoros illeszkedésű (1. ábra).
A tércentrált köbös rács (BCC) a atomok sarkainál egy kocka és egy másik atom közepén a kocka térfogata. lapközepes köbös rács (FCC) -atom található a kocka sarkokban és a központ minden egyes arc, a hexagonális rács atomok találhatók a sarkok és központ a hatszög hasáb bázis és a három atom a másodlagos prizma síkban.
Cubic BCC fémek :. Na, Li, W, V, Cr, stb FCC köbös rács van Pb, Ni, Ag, Au, Cu és egyebek.
A méretei a kristályrács jellemzi a paramétereket vagy osztásperiódus. Köbös rács meghatározza egy paraméter - hossza a kocka éle. A paraméterek a sorrendben atomi méretei és mért angström.
Egyes fémek tetrago rácsszerszerkezetűek ez jellemzi az a tény, hogy a széle nem egyenlő a szélén is. Az arány a ezeket a paramétereket jellemző az úgynevezett foka tetragonalitást. A atomok száma a legközelebbi távolság egy adott atom az úgynevezett koordinációs száma. Például, egy atom egy egyszerű köbös rács hat egyenlő távolságra lévő legközelebbi szomszédok, azaz a koordinációs száma a rács egyenlő 6 (ábra. 2).
A központi atom a szervezetben-központú rács nyolc egyenlő távolságra lévő legközelebbi szomszédok, azaz Ennek a hálónak koordinációs szám 8. A koordinációs száma lapközepes rács 12. Abban az esetben, hexagonális szoros illeszkedésű rács koordinációs száma 12.