Móltömeg ammónia (NH3), és példák a általános képletű
Móltömeg ammónia
Ammónia normál körülmények színtelen gáz egy szúrós, fojtó szagú.
Ammónia-molekula az alakja trigonális piramis (DNH = 0,10 nm, a szög 107,3 HNH 0) módszer szerint a vegyértékkötéseket, ez megfelel sp3 hibridizációs vegyértékei orbitálok nitrogénatom (ábra. 1). Ammónia jól oldódik vízben: egy térfogatrész víz oldja szobahőmérsékleten mintegy 700 térfogatrész ammónia. A koncentrált oldatot tartalmaz 25% (tömeg). NH3, és a sűrűsége 0,91 g / cm 3 előállítása ammónia ammóniás víz nevezzük.
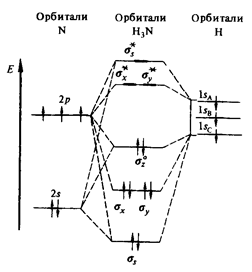
Ábra. 1. ábra A pályák a molekula ammónia.
Molekuláris képlet Ammónia - NH3. Mint ismeretes, a molekulatömege a molekula az összege a relatív atomi tömegek a atom alkotja a molekula (relatív atomtömeg értékeket vett Mendeleev Periódusos Táblázat egész számra kerekítve).
Mr (NH3) = Ar (N) + 3 × Ar (H);
Mr (NH3) = 14 × 3 + 1 = 14 + 3 = 17.
Móltömeg (M) - a súlya 1 mol hatóanyagra vonatkoztatva. Könnyen azt mutatják, hogy a számértékek a moláris tömege, és a relatív molekulatömeg úr egyenlő, de az első érték az alábbi méretekkel rendelkezik [M] = g / mol, és egy második dimenzió:
Ez azt jelenti, hogy a moláris tömege ammónia 17 g / mol.