A parciális nyomása gázok
A parciális nyomása a gázok. A nyomás a vízgőz
Feloldjuk vízben vagy testszövetekben is nyomás alatt lévő gázok, mert a molekulák az oldott gáz véletlenszerű mozgásban, és rendelkeznie kinetikus energia. Ha feloldjuk egy folyékony gázt megtámadva a felszíni, például a sejtmembrán, akkor ez ugyanolyan parciális nyomása, mint a gáz a gázkeverék. A parciális nyomása a gázok a vízben oldott jelzésig hasonló jelölésére a parciális nyomása a gázkeverék, azaz PCO2 Po2, Pn2, PH20, Phe, stb
Meghatározó tényezők a nagysága a parciális nyomása az oldott gáz a folyadék. A parciális nyomása a gáz oldatban határozza meg nem csak a koncentráció, hanem annak oldhatóságától együttható, azaz a Bizonyos típusú molekulák, mint például a szén-dioxid, a természetes vagy kémiailag kapcsolódnak molekula víz és egyéb - taszítják. Felhelyezésekor még a molekulák nagy mennyiségű nem befolyásolja a parciális nyomás az oldatban. Ezzel szemben, ha van még molekulák taszítják parciális nyomása kevesebb oldott molekulák. Ezt az összefüggést nevezzük Henry-törvény, és kifejezte a következő képlet szerint:
= Parciális nyomása az oldott gáz koncentráció / oldhatóság együttható.
Ha a parciális nyomása kifejezve atmoszféra (1 atmoszféra = 760 Hgmm ..), koncentrációja és a - a gáz térfogata oldjuk egyes térfogatú vízzel, majd a test hőmérséklete fontos a folyamat a légzés gázok oldhatósága alábbi együtthatókat:
oxigén 0,024
Szén-dioxid 0,57
Szén-monoxid 0,018
nitrogén 0.012
hélium 0008
Nyilvánvaló, hogy a oldhatósága a szén-dioxid által több mint 20-szor magasabb, mint a az oxigén oldhatósága, így a parciális szén-dioxid nyomás (egy adott koncentráció) kisebb, mint 1/20 az oxigén parciális nyomása.
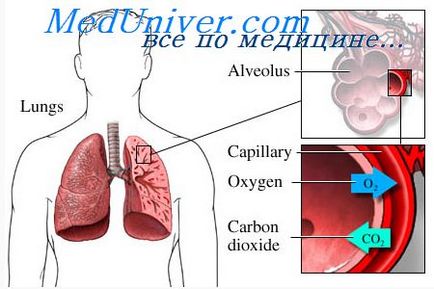
Diffúziós gáz a gáz fázisból az oldott fázisban és alveolusok pulmonális kapillárisokban lévő vért. A parciális nyomása az egyes gázok a gázok keveréke (alveoláris levegő) okozza a molekulák ezen gáz beköltözik az alveoláris kapillárisok és ott, hogy feloldódjon a vérben. Ugyanakkor, a már oldott a vérben a gázmolekulák mozoghatnak a vér folyékony részéből, és néhány esik vissza az alveolusokba. Számuk egyenesen arányos a parciális nyomása a gáz a vérben.
Mi az irányt gázdiffúzióval a domináns? Az uralkodó diffúziós iránya határozza meg a különbség a két parciális nyomás. Ha a parciális nyomása gázt vezetünk át a gázfázisú (az alveoláris levegő), mint általában a helyzet az oxigén, a nagyobb molekulák számát adja át a vérbe. Ha a gáz parciális nyomása nagyobb az oldott fázisban a vér, ami általában igaz a szén-dioxid, a uralkodó irányába gázdiffúziós kerül a kimenetre az alveolusokba.
A nyomás a vízgőz
Belélegzés demoisturized levegőt a légúti felületein a víz azonnal elpárolog és nedvesíti a levegőt. Ez azért van, mert a vízmolekulák valamint azok a molekulák különböző gázok kioldjuk folyamatosan a felületi réteg a víz a gázfázisban fölötte. A parciális nyomás alatt, amely hatására a vízmolekulák található a felületén, az úgynevezett víz gőznyomását. A normális testhőmérsékleten (37 ° C) vízgőz nyomása 47 Hgmm. Art. Azonban teljes nedvesítése a gáz elegy, vagyis amikor egyensúlyi víz fordul elő két fázisban, a parciális nyomása vízgőz a gázkeverék 47 Hgmm. Art. Mint a többi parciális nyomása, akkor nevezzük RH2O.
A nyomás a vízgőz teljesen függ a víz hőmérséklete. Minél magasabb a hőmérséklet, annál nagyobb a kinetikus aktivitását a molekulák, ezért valószínűbb felszabadulását vízmolekulák a felületről a gázfázisba. Például, a gőznyomása vízben 0 ° C-on 5 Hgmm. Art. és 100 ° C - 760 Hgmm. Art. Fontos megjegyezni, a víz gőznyomása a normális testhőmérsékleten - 47 Hgmm. Cikk.; Ezt az értéket az említett jövőbeni viták.