ozmotikus nyomás
Ozmotikus nyomás (jelöljük π) - túlzott hidrosztatikus nyomást a megoldást. tiszta oldószer elválasztjuk a féligáteresztő membrán. ahol az oldószer leáll diffúziós a membránon keresztül (ozmózis). Ez a nyomás hajlamos, hogy kiegyenlítse a koncentrációja mindkét megoldás miatt oldat kölcsönös diffúziója molekulák és oldószer.
Annak a mértéke, az ozmotikus nyomás gradienst, vagyis a potenciális különbség a két vizes oldat elválasztva egy féligáteresztő membrán, úgynevezett tonicitást. Egy megoldás, amelynek nagyobb ozmotikus nyomás, mint egy másik megoldás, az úgynevezett magas vérnyomású amelynek alsó - hipotóniás.
Kölcsönhatás erit-megoldások alapján azok ozmotikus nyomás.
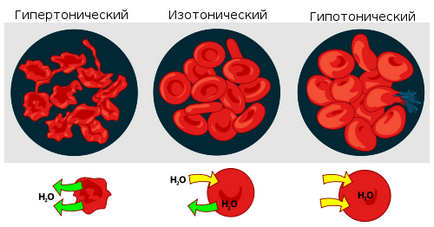
Ha egy ilyen megoldás a zárt térben, például egy vérsejt. az ozmózisnyomás lehetett törés a sejtmembránon. Ez az oka annak, hogy a gyógyszert. beadásra a véráramba, feloldjuk izotóniás oldatban. tartalmazó nátrium-klorid (NaCl), mint szükséges, hogy egyensúlyt az ozmotikus nyomás a folyadék a sejt által termelt. Ha beadott gyógyszereket készült vízzel vagy nagyon híg (hipotóniás képest a citoplazmába) oldatot, az ozmotikus nyomást, ami a víz behatolását a vérsejtek vezetne a szakadás. Ha ez a véráramba kerülését, túl tömény nátrium-klorid oldattal (3-10%, hipertóniás oldatok), a vizet a sejtekből megy kifelé, és összezsugorodik. Abban az esetben, növényi protoplaszt sejtek leválnak a sejtmembránon. mi is nevezzük plazmalizálódnak. Fordított ugyanaz a folyamat előforduló szobahőmérsékleten fodros sejtek több híg oldatban, - ill deplazmolizom.
A nagysága az ozmózisnyomás által létrehozott megoldás számától függ, nem a kémiai természetétől az oldott anyagok (vagy ionok. Ha az anyag disszociált molekulák), ezért, az ozmotikus nyomás az oldat testületi tulajdonság. Minél nagyobb a koncentrációja egy anyag az oldatban. A nagyobb az ozmotikus nyomás által létrehozott. Ez a szabály, az úgynevezett törvénye ozmotikus nyomás, kifejezve egy egyszerű képlet, ami nagyon hasonlít egy bizonyos ideális gáztörvény:
Ez is mutatja, a hasonlóság a tulajdonságait az oldott anyag részecskék viszkózus oldószerben részecskéivel ideális gáz a levegőben. A érvényességét a szempontból is megerősíti kísérletek Perrin J. B. (1906): a eloszlása az emulzió részecskék gumigyanta gyantát a vízben oszlop általában alárendelt Boltzmann törvény.
Az ozmotikus nyomást, amely attól függ, hogy a tartalom fehérjék oldatban, az úgynevezett onkotikus (0,03-0,04 atm). A tartós koplalás, vese fehérje koncentrációja a vérben csökken onkotikus nyomás a vérben csökken, és ott onkotikus ödéma. vizet át hajók egy szövet, ahol πONK több. Amikor πONK gennyes folyamatokat a gyulladás növekszik 2-3 alkalommal, mivel növeli a részecskék száma miatt a megsemmisítése fehérjék.
A szervezetben, az ozmotikus nyomást állandónak kell lennie (körülbelül 7,7 atm). Ezért, izotóniás oldatok juttatnak a betegekbe (oldatok, ozmotikus nyomás, amely egyenlő πplazmy ≈ 7,7 atm (0,9% NaCl -. Sóoldatban, 5% glükóz oldatban) hipertóniás oldatok, amelyekben π nagyobb, mint πplazmy használják a gyógyászatban .. tisztító sebek genny (10% NaCl), hogy eltávolítsuk a allergiás ödéma (10% CaCl2. 20% glükóz), mint a hashajtó gyógyszerek (Na 2SO 4 ∙ 10H2 O. MgSO 4 ∙ 7H2 O).
ozmotikus nyomást törvényt lehet kiszámítani a molekulatömeg az anyag (bizonyos kiegészítő adatokat).
Indokolás képlet van't Hoff a termodinamikai pont
Az oldatot, a szabad energia G = G 0 + R T l n x A + π V C + RTlnx _ + \ pi V_>. ahol x A - moláris részt az oldatból, V C> - annak moláris térfogata. A megjelenése tagja a π V C> egyenértékű a bevezetése a szabad energia a külső nyomás. A tiszta oldószerre G = G 0>. Amikor ∇ G egyensúlyi oldószeres nulla. Így
0 = ∇ G = G 0 + R T l n x A + π V C - G 0 = R T L N x A + π V C + RTlnx _ + \ pi V_-G ^ = RTlnx _ + \ pi V _,>
azaz képletű Ya kapott van't Hoff (π = c R T).
Annak kiürülés kiszámítani, hogy x B> - kicsi. Ez lehetővé teszi, hogy elterjedt l n (1 - x B))> egy sorban, és alkalmazza a továbbiakban aránya x B ≅ n B n A. \ Cong >>> A terméket n-A V C> híg oldatok lényegében egyenlő a oldat térfogata ..
A kolloid ozmotikus nyomást
A előfordulása ozmotikus nyomás, két feltételnek kell teljesülnie:
- jelenlétében egy féligáteresztő partíció (membrán);
- jelenléte mindkét oldalán a membrán különböző koncentrációjú vizes oldatainak.
Membrán megfigyelő számára részecskéket (molekulákat) egy bizonyos méretet, így, például, hogy szelektíven áthaladnak a pórusokon vízmolekulák anélkül, hogy hiányzik az etil-alkohol-molekula. A gázkeverék - hidrogén és nitrogén - a szerepe egy szemipermeábilis membrán képes végrehajtani palládium vékony fólia, amelyen keresztül a hidrogén diffundál szabadon, míg a nitrogén majdnem nem hiányzik. keresztül egy ilyen membrán lehet elválasztani keverékét hidrogén és nitrogén be az egyes komponenseket.
Egyszerű és hosszú ismert példái a membránok, amelyek a vízzel szemben áteresztők, és át nem eresztő, hogy sok más oldott anyagok bőr, pergament, és más állati és növényi szövetekben.
Pfeffer keresztül ozmométer, ahol a félig-áteresztő membrán alkalmazott porózus, porcelán kezelt C u 2 F e (C N) 6, Fe (CN) _>. Vizsgáltam az ozmotikus nyomás a vizes oldatok a nádcukor. Ezen mérések alapján van't Hoff 1885 felajánlotta empirikus egyenlet, amely szabályozza az ozmózisnyomás π hígított oldatok:
ahol c = n / V - oldott anyag koncentrációja, mol / m³.
Ez az egyenlet egybeesik a formában Boyle-törvény az ideális gázok. Ezért, az ozmotikus nyomás a hígított oldat lehet meghatározni, mint a nyomás, amely termel azonos mennyiségű oldott molekulák, mintha formájában egy ideális gáz egy adott hőmérsékleten elfoglalt térfogata azonos a térfogata az oldat.
Van't Hoff-egyenletből lehet konvertálni néhány, helyettesítésével koncentrációja c i = n i / V = m i / M i v = N_ / V = M_ / M_V>:
ahol m i> - tömege az oldott anyag koncentrációja; M i> - a molekulatömeg.
Mint ilyen, a van't Hoff-egyenletből széles körben használják, hogy meghatározzák a molekulatömege az oldott anyag. Ozmotikus módszert gyakran használják, hogy a moláris tömege, nagy molekulatömegű vegyületek (fehérjék, poliszacharidok, és mások). Ez elegendő ahhoz, hogy mérni az ozmotikus nyomás az oldat ismert koncentrációjú.
Ha az anyag disszociált az oldatban, az ozmotikus nyomás nagyobb lesz, mint a számított Adagolás és izotóniás arány:
Van't Hoff csak akkor érvényes, híg oldatok, amelyek engedelmeskedik Raoult törvény. Nagyobb koncentrációkban a megoldások c i> az utolsó egyenlet meg kell változtatni, hogy egy 1 Activity> vagy fugacitás f 1 ..>
A szerepe ozmózis biológiai rendszerekben
Az a jelenség, hogy az ozmózis és ozmózisnyomás játszik nagy jelentőségű a biológiai rendszerekben, amelyek egy féligáteresztő membrán formájában különböző szövetekben, beleértve a sejtmembránok. Állandó ozmózis víz a sejtekbe létre túlzott hidrosztatikus nyomás, amely ereje és rugalmassága a szövetek, amely az úgynevezett turgor.
Ha egy sejt, mint a vörösvérsejt, helyezzük desztillált vízzel (vagy igen híg oldatban a só), a víz behatol a sejtbe, és a sejt megduzzad. A duzzadás folyamán vezethet törés a vörösvérsejt membrán, ha van úgynevezett hemolízis.
Processes emésztésével, anyagcsere szorosan kapcsolódik különböző permeabilitási szövetek víz és más oldott anyagokat.
Ozmotikus nyomás visszanyeri szerepet mechanizmust, amely biztosítja a tápanyagok sejtek; A múltban a magas fák emelkedik a magassága több tíz méter, ami megfelel a ozmózisnyomás több tíz atmoszféra. Tipikus sejtek a protoplazma kialakítva megtöltött zsákok vizes oldatait különböző anyagok (sejtnedv) van egy bizonyos értéket a nyomás, a nagysága, amelyet belül mért 0,4-2 MPa.