atomelméletét
Modell nitrogénatom
Valamennyi szerv, amely a bennünket körülvevő, annak ellenére, hogy a sokféleség, állnak apró részecskék - atomok, amely viszont, a még kisebb részecskék - protonok, neutronok, és elektronok. Ismertté vált az utóbbi időben, az atom már régóta tekintik oszthatatlan részecske, azaz egy egyszerű (lásd a történelem, a koncepció az atom).
A modern elmélet atomi szerkezete alapján a következő főbb pontokat:
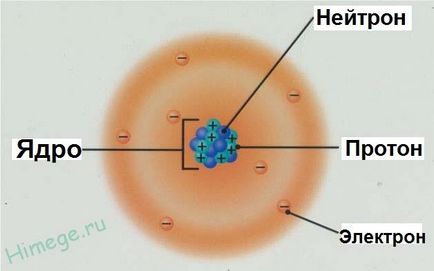
- Atom áll egy atommag és az elektron héj
- Elektronikus héj - egy sor mozgó elektronok az atommag körül
- Atommagok pozitív töltésű, akkor állnak protonok és a neutronok p n (együtt nevezik nukleont) .Zaryad mag összegével egyenlő a protonok (pirossal jelölve az ábrán).
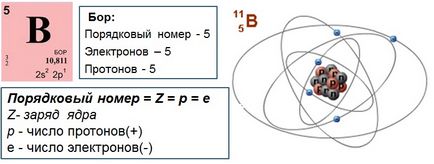
- Atom elektromosan semleges, mint egész, az elektronok száma egyenlő a protonok száma e p +. egyenlő a sorszáma az elem a periódusos rendszerben. Ez a nukleáris töltet a fő jellemzője az atom, és meghatározza annak helyét a periódusos rendszerben. Himicheskiyelement - gyűjteménye atomok azonos felelős a sejtmagban.
- Ha atom tulajdonít vagy veszít elektronokat (negatív töltéshordozók) annak elektroneutralitás van törve, hogy átalakítunk egy negatív vagy pozitív töltésű ion, ill.
A formáció a pozitív töltésű ion csökkenti az elektronok száma (a díj összegének a ion), és a kialakulása egy negatív töltésű ion növeli az elektronok száma (a díj összegének a ion).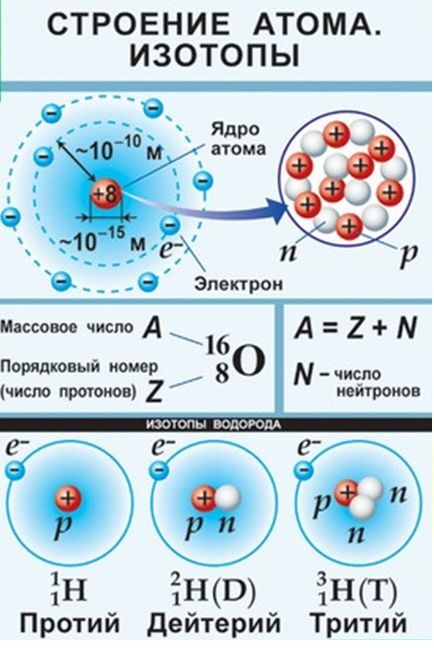
E0 + NE - = felvilágosodás
Az atomok kis nehéz magok, amelyek protonok és a neutronok, melynek középpontjában majdnem az egész tömeg az atom. A legtöbb atom töltött elektronok és majdnem üres tér.
A természetben vannak atomok egy elem, vagyis az azonos felelős a sejtmag, de különböző tömegű szám - izotópok (ógörög ισος -. «Equal”, »azonos« és τόπος - «hely”, foglalja el ugyanazt a „hely” a periódusos táblázat). Ők ugyanazt a protonok száma, de különböző számú neutront. Y elem hidrogénatom létezik három izotópok: Protium - tömegszáma 1, deutérium - tömeges száma 2 (D 2O - nehézvíz), és a radioaktív trícium tömegszáma 3.
A periódusos rendszer mutatja a relatív atomsúlya - átlagos aritmetikai izotóp tömeg% a tartalmuk alapján a kéregben.
A neutronok száma nincs megadva a táblázatban, így kiszámításához a neutronok száma, szükség van a tömeg az atom (jelzett a munkát), hogy levonja a sorozatszámot (a protonok száma).
A kompozíció a kémiai reakciók az atommagok nem változik (kivéve a nukleáris reakció -. Nem tekinthető ebben természetesen a tanulmányi Physics) változhat csak az összetétele az elektron héj (elektronok száma). Ezért fontos tudni, hogy az elektronok egy atom vannak elrendezve, azaz a szerkezet a elektronhéjak atomok.
Az elektronok vannak elrendezve háromdimenziós térben bárhol atommag. Ezen belül vannak olyan régiók, ahol az elektronok is található pro-tér. Ezek a területek az úgynevezett pályák. Mindegyik orbitális jellemzi a mérete, alakja és tájolása belül az atom, és mindegyik hozzárendelt alfanumerikus kijelölése.
Bár nagyszámú atom pályák, normál körülmények között csak egy viszonylag kis részét foglalja el elektronokat. A következő felsorolás Xia első hagyományos jelölést (m. E. Legközelebb a mag) tizennyolc pályák. Az ábra (szám) jellemzi a mérete vagy átmérője-TION média orbitális és karakter - formájában pályák. s-képviselet-Orbital kívánságát, hogy hozzanak létre egy gömb, amelynek középpontja egybeesik a központ (mag) atom, és három p pályák hasonlítanak volumetrikus nyolc tengelyek merőlegesek egymásra. Így, 1s-orbitális - gömb-kai, és a legkisebb méretű; 2s-orbitális - szintén gömb alakú, de a fájdalom-Sheha méretű; 2p-pályák olyan az alakja és mérete nyolcas éves szinten-ble a 2s-orbitális. d-pályák egy bonyolultabb alakú.
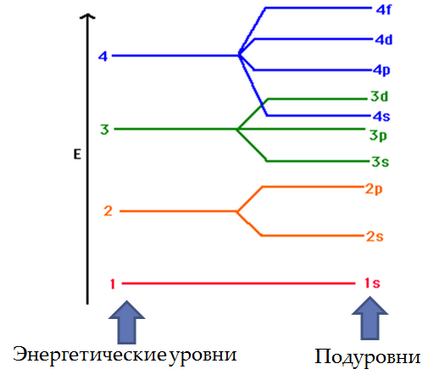

Pályák vannak csoportosítva méretük alapján, és ezeket a csoportokat nevezzük rétegek vagy kagyló vagy energiaszintet. Az első elektron héj csak egy orbitális - 1s. A második héj az utolsó négy, a harmadik - kilenc. Minden orbitális lehet szabad (üres) vagy foglalnak egy vagy két elektront. Megjegyezzük, hogy az egyes-span mintegy (kivéve az első) három p pályák és öt d-pályák (összes membránok kivéve az első két). Mivel minden egyes pályára, lehet, hogy 2 elektron sáv p-pályák elfoglalhatnak nem több, mint 6 elektronok, és a D csoport-orbitaley - 10 elektronok.
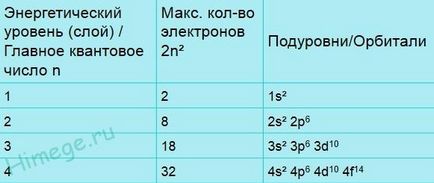
Az alábbiakban az elektronikus konfigurációját az oxigén és kénatom.
