OF2, az oxidáció mértékét az oxigén és a fluor benne
Általános információk az oxigén-fluorid és az oxidáció mértékét a OF2
Fluorid oxigén normál körülmények között gáz világossárga (majdnem színtelen), ellenáll a fény és bomlik hevítve (molekulaszerkezet ábrán látható. 1).
Molekuláris képlet - OF2. Móltömeg - 54 g / mol. Olvadáspont (-223,8 ° C) forráspontú - (-144,8 ° C).
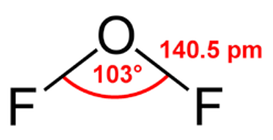
Ábra. 1. A szerkezet az oxigén-difluorid molekula jelezve a kötés szög és kötéshossz.
A folyékony állapotban a levegő jól oldódik. Rosszul oldódik hideg vízben, és lassan reagáljon rá. Ez egy erős oxidálószer.
OF2, az oxidációs állapotát elemek benne
Annak meghatározására, az oxidáció mértékét a alkotó elemek az oxigén-fluorid először foglalkozni az említett elemeket, amelyek ezt az értéket pontosan ismert.
Fluor mutat állandó mindig megegyezik az oxidáció mértékét (-1). Ahhoz, hogy megtalálja a mértéke oxigén oxidációs elviszi az ár-érték „x”, és határozza meg a elektroneutralitás egyenletet:
Ezért az oxidáció mértékét egy oxigén-fluorid oxigén (2):
Példák problémák megoldása
A legnagyobb fokú oxidációját a központi tag gidroksosoedinenii:
Ahhoz, hogy megtalálja a helyes válasz erre a kérdésre viszont, hogy ellenőrizze minden egyes javasolt lehetőségeket.
a) A központi atom klóratom. Tegyük fel, az értéke az oxidáció mértékét a klór per „x”, és alkotják a elektroneutralitás egyenletet. Az oxidáció mértéke az oxigén és hidrogén (-2) és (1) rendre.
1 + (-2) x + + 2 × (-2) = 0;
b) A központi atom a foszfor. Tegyük fel, hogy a értéke a „y”, és alkotják a foszfor oxidációs elektroneutralitás egyenlet. Az oxidáció mértéke az oxigén és hidrogén (-2) és (1) rendre.
3 × 1 + 3 × (-2) + + y (-2) = 0;
c) a központi atom kénatom. Tegyük fel, az érték a mértéke a kén oxidáció «z» és alkotják a elektroneutralitás egyenletet. Az oxidáció mértéke az oxigén és hidrogén (-2) és (1) rendre.
2 × 1 + 2 × (-2) + z + 2 × (-2) = 0;
g) A központi atom a foszfor. Tegyük fel, az értéke a oxidációs állapotának foszfor „A” és a elektroneutralitás egyenletet. Az oxidáció mértéke az oxigén és hidrogén (-2) és (1) rendre.
3 × 1 + 3 × (-2) + a = 0;
A legalacsonyabb érték egyenlő az oxidációs állapot (3), ez jellemző a készítmény foszfor a vegyület (HO) 3 P.