Mi vegyértékével oxidációs állapotban az oxigén és az oxidáció mértékét az oxigén
Minden, amit levegőt lélegezni, hogy többnyire a nitrogén és oxigén molekulák kisebb hozzáadásával más elemek. Így, az oxigén az egyik legfontosabb kémiai elemek. Továbbá, a molekulái vannak egy hatalmas különféle kémiai vegyületek, amelyek használják a mindennapi életben. Ahhoz, hogy leírja az összes tulajdonságait ez az elem nem elegendő, és száz oldalt, így korlátozzák az alapvető tényeket a történet, valamint az alapvető elem jellemzői - valencia és az oxidáció mértékét az oxigén aránya alkalmazásának alapvető fizikai tulajdonságait.
Története a felfedezés egy kémiai elem
Oxigén - különösen a molekulaszerkezet
Aktív kémiai elem színtelen gáz, szagtalan és íztelen. Kémiai képlet - O2. A kémikusok hívja rendes kétatomos oxigén vagy „légköri oxigén”, vagy „dioxigénnel.”
A vegyértéke oxigén és az oxidáció mértékét
Az vegyértéke egy kémiai elem van tartva annak képessége, hogy egy bizonyos számú atomok más kémiai elemek. A vegyértéke oxigén két. A vegyérték az oxigén molekula is egyenlő két, mivel a két atom egymáshoz csatlakoztatva, és megvan a képessége, hogy csatolja a szerkezetét akkor is, egy atom egy másik vegyület, azaz kovalens kötést vele. Például, egy vízmolekula H2 O kialakulását eredményezi a kovalens kötések egy oxigénatomot és két hidrogénatom.
Oxigén megtalálható számos ismert kémiai vegyületek. Van még egy külön típusú kémiai vegyület - oxidok. Ez az anyag kombinálásával nyert gyakorlatilag bármilyen kémiai elem oxigénnel. Az oxidáció mértéke az oxigén a oxidok egyenlő -2. Azonban, bizonyos vegyületek ez a szám eltérő lehet. Többet, hogy az alábbiakban ismertetjük.
Fizikai tulajdonságok oxigén
Normál kétatomos oxigén gáz, amelynek nincs színe, szaga és íze. A normális állapotban, a sűrűség - 1,42897 kg / m 3 tömege 1 liter anyag valamivel kevesebb, mint 1,5 gramm, azaz tiszta oxigént a levegőnél nehezebb. Amikor melegítjük, a molekula disszociált atomokra.

Amikor a közeg hőmérsékletet lecsökkentjük -189,2 C. oxigén következtében megváltozik a szerkezet a gáznemű, hogy a folyadék. Tehát van egy forraljuk. Amikor a hőmérséklet csökken, -218,35 ° C változás áll, hogy a szerkezet a folyadékkristály. Ezen a hőmérsékleten az oxigén formájában van kékes kristályok.
Szobahőmérsékleten, az oxigén alig oldódik vízben - annak egy liter 31 milliliter oxigén. Oldhatóság egyéb anyagokkal: 220 ml 1 liter etanolt, 231 ml 1 liter acetonban.
Kémiai tulajdonságok oxigén
Együtt az alkálifém aktív oxigén formák szuperoxidok vagy szuperoxid. Ilyen szerkezetek például a következők:
A különlegessége az, hogy az oxidáció mértékét a oxigén a szuperoxid -1/2.
Együtt a legaktívabb kémiai elem - fluor-, fluoridok kapunk. Rájuk lesz szó az alábbiakban.
Magasabb oxidáció mértéke az oxigén-vegyületek
Attól függően, hogy milyen anyagot reagáltatjuk oxigén, oxigénnel hét oxidációs fokú:
- -2 - a-oxidok és szerves vegyületek.
- -1 - a peroxid.
- -1/2 - a szuperoxid.
- -1/3 - szervetlen ozonidot (igaz háromatomos oxigén - ózon).
- +1/2 - a sók oxigén kation.
- +1 - a monofluoride oxigént.
- +2 - az oxigén-difluorid.
Amint látható, a magasabb, az oxidáció mértékét az oxigén elért oxidok és szerves vegyületek, és fluoridok azt is pozitív energia. Nem minden típusú interakciók végezhetjük természetes módon. A formáció bizonyos vegyületek speciális feltételek szükségesek, mint például a magas nyomású, magas hőmérsékletű, expozíciós ritka vegyületek, amelyek szinte soha nem található meg a természetben. Tekintsük az alapvető oxigén vegyület más kémiai elemeket: a oxidokat, fluoridokat és peroxidok.
Osztályozás oxidok a sav-bázis tulajdonságai
Négyféle oxidok:
Az oxigén oxidációs az ilyen típusú vegyületek -2.
- Basic oxidok - egy olyan vegyület, fémeket alacsony oxidációs állapotok. Jellemzően, savval reagáltatva kapjuk a megfelelő sóvá, és a víz.
- Savas oxidok - nemfém-oxidokat egy magas oxidációs fok. A fentieken túlmenően a víz képződik sav.
- Semleges oxidok - vegyületek, amelyek nem lépnek bármilyen reakciót savakkal vagy bázisokkal.
- Amfoter oxidok - vegyületek fémekkel, amelyek kis elektronegativitási értéke. Ezek, a körülményektől függően, olyan tulajdonságokkal rendelkeznek, és a savas és bázikus oxidok.
Peroxidok, a mértéke az oxigén a oxidációját hidrogén-peroxid és más vegyületek
Peroxidok úgynevezett oxigén vegyületek alkálifémekkel. Ezeket úgy állítjuk elő, égés ezen fémek oxigénnel. Peroxidok szerves vegyületek rendkívül robbanásveszélyes. Ezek is előállíthatjuk, az oxigénfelvételt oxidok. Példák a peroxidok:
Mindegyikük az a közös, hogy azok tartalmaznak oxigént -O-O-. Következésképpen, az oxigén az oxidációs foka -1-peroxidok.

Más típusú peroxidok közül
- szuperoxidok (szuperoxidok, amelyben oxigén van az oxidációs -1/2);
- szervetlen ozonidok (rendkívül instabil vegyület, amelynek saját anion szerkezete ózon);
- molozonide (vegyület, amelynek egy kötés -O-O-O- a szerkezetében).
Fluoridok, az oxidáció mértékét oxigénben OF2
Fluor - a legtöbb aktív tagja az összes jelenleg ismert. Ezért, a reakció az oxigén és a fluor, hogy nem-oxidok, és a fluoridok. Ők így nevezték, mert ez a vegyület nem az oxigén, és a fluor egy oxidálószer. A fluorid nem szerezhető természetes módon. Az egyetlen szintetizált extrahálásával társulás az fluorral vizes KOH. oxigén fluoridok vannak osztva:
Tekintsük részletesebben az egyes vegyületek. oxigén-difluorid a struktúrájában egy színtelen gáz egy erős, kellemetlen szag. Lehűlés után kondenzáljuk egy sárgás folyadék. A folyékony vízzel rosszul elegyedő, de jó légi, fluoratom és az ózon. Kémiai tulajdonságait oxigén difluorid - egy nagyon erős oxidálószer. Az oxidáció mértéke oxigénben OF2 értéke 1, azaz ez a vegyület fluor oxidálószer és az oxigén - redukálószer. OF2 nagyon mérgező, több, mint a tiszta fluor és közel van a foszgén a mértéke a toxicitás. A fő alkalmazása ilyen vegyület - mint oxidálószer a hajtógáz, mivel az oxigén-difluorid nem robbanásveszélyes.
monofluoride oxigén a normál állapotban egy, sárgás szilárd. Olvadáskor képez vörös folyadék. Ez egy erős oxidálószer, rendkívül robbanásveszélyes érintkező szerves vegyületek. Ez a vegyület az oxigén oxidációs állapotú +2, azaz ebben a Fluorid oxigén-vegyületek, mint redukálószerrel, és fluor - oxidáns.
Ózon és vegyületei
Az ózon - olyan molekula, amelynek három oxigénatomból egymáshoz kötve. A normális állapotban kék gáz. A hűtés során a folyékony formák sötétkék színt közel indigó. A szilárd kristály sötétkék színű. Az ózon szúrós szagú, akkor természetesen érzem a levegőben, miután egy súlyos vihar.
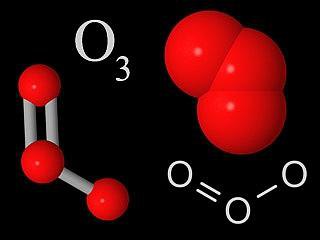
Mivel az ózon egy nagyon erős oxidálószer és szinte minden folyamat való részvételével nagy mennyiségű O2. Ezután az ózon rendkívül mérgező anyag. Azonban a felső légkörben ózonréteg szerepet tölt be a reflektorral ultraibolya sugarakkal.
Mivel az ózon segítségével laboratóriumi eszközöket hozzon létre a szerves és szervetlen ozonidok. Ez egy nagyon instabil az anyag szerkezetét, így a teremtés természetes körülmények között lehetetlen. Ozonidok tárolják csak alacsony hőmérsékleten, mivel a szokásos hőmérsékleten, ezek rendkívül toxikus és robbanékony.
Az oxigén alkalmazása és vegyületei az iparban
Annak a ténynek köszönhetően, hogy egy időben, a tudósok megtanulták, milyen mértékű oxidáció oxigén- a kölcsönhatás más elemek, azt és annak vegyületeket széles körben használják az iparban. Különösen azután, hogy a huszadik század közepéig találták turbo bővítők - egység átalakítására képes oxigént mechanikai energiát.

A vegyiparban, oxigént használunk oxidálószerként sav-szénhidrogén-vegyületek, mint például alkoholok, savak és hasonlók. D. A gyógyszert használnak csökkentett nyomáson betegek tüdő problémák, hogy fenntartsák az élet a szervezetben. A mezőgazdaságban, kis adag tiszta oxigént tenyésztésre használt halak a tavakban, növelésére aránya szarvasmarha és hasonlók. D.
Oxigén - egy erős oxidálószer, amely elengedhetetlen a megléte
Fent volt egy csomó írott mit oxigén oxidációs állapotban, amikor belépnek reakció különböző vegyületek és elemek, milyen oxigén vegyületek vannak, milyen típusú életveszélyes, és melyek nem. Lehet továbbra is tisztázatlanok - mint minden toxicitása és a magas szintű oxidációs oxigén egyik elemét, amelyek nélkülözhetetlenek a földi élet? Az a tény, hogy a mi bolygó egy nagyon kiegyensúlyozott testet, amely úgy van kialakítva kifejezetten a anyagoknak légköri réteg. Ő részt vesz a ciklus, amely a következő: az ember és az összes többi állat oxigént fogyasztanak, és szén-dioxidot termel, és a növények túlnyomó többsége fogyasztanak szén-dioxid és oxigént termelnek. A világon minden mindennel összefügg, és a veszteség egy láncszem lehet megtörni az egész láncot. Ne felejtsük el, róla, és vigyázni az élet a bolygó egésze, nem csak az egyes képviselőivel.


10 érdekes tény az intimitás, amiről valószínűleg nem tudja Tekintse meg a legérdekesebb és lenyűgöző tények a szexuális aktivitást, amely lepni.

Mi történik az emberi szervezetben, ami nem a szex? Sex - közel azonos alapvető szükségletek, mint az élelmiszer-bevitelt. Legalábbis kezdtek csinálni, akkor nem hagyja abba. Még ha priderzhivaetes.
