Gyakorlati alkalmazási № január 3
Gyakorlati alkalmazási ammónia № 3. előállítása és vizsgálata annak tulajdonságait. Bevezetés a tulajdonságait vizes ammónia
Problémák megoldása a különböző tantárgyak
Feltételek feladatok: Practice № 3. előállítás ammónia és tanulmányozása tulajdonságait. Bevezetés a tulajdonságait vizes ammónia
Cél száma 3
Megbízásokat. 1. ammóniává történő reakcióval kalcium-hidroxid, ammónium-klorid.
2. felfedezése néhány fizikai tulajdonságai ammónia (szín, szag, relatív sűrűség, oldhatóság vízben).
3. Tanulmány reagáltatjuk vizes ammónia, salétromsav és sósav.
4. Ismétlés reakciók szerint: a) közötti az ammóniás oldathoz vizet és kénsavat, és b) közötti ammónium-hidroxid-oldatot és vas-klorid (III).
Vegye figyelembe a biztonsági utasításokat a kísérleteket!
Felszerelés. Részletek az eszköz előállítására ammónia, laboratóriumi állvány állvány csövek, porcelán habarcsot mozsártörővel, spatulával vagy kanál, üveg rudak (2 db.), A csőtartó, egy fűtőtest.
Anyagok. A kristályos kalcium-hidroxid és ammónium-klorid; tömény sósavat, tömény salétromsav és 20% kénsav -I; víz (üveg), a fenolftalein-oldatot, vas-klorid-oldatot (III).
munkavégzés
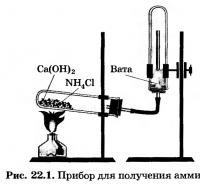
Előállítása ammónia. Gyűjtsük össze a készülék az ammónia előállítása (ábra. 22.1), a szivárgást. mert
csatolja állványra úgy, hogy kényelmes a hő a cső. Döntse milyen helyzetben a csövek (ábra. 22.2, a, b, c vagy d) helyes.
Készítsünk három száraz (miért?) Csövek kell tölteni ammóniával. Zárja lezáróeszközeik.
A habarcs öntsünk egy kanál ammónium-klorid és a kalcium-hidroxid, keverjük össze őket, a cefre mozsártörő. Ezután a keveréket egy csőbe helyezzük, az eszköz megfelelő részével, feltöltése nem több, mint 1/3.
Első, hogy a hő a cső tartalmát először melegítjük az egész cső égő lángja, majd közvetlen a láng úgy, hogy a felület a felmelegített keverék.
Töltsük három csövet ammónia dugó tartók lezáróeszközeik; Állítsa fűtés és szétszerelése nélkül a készüléket, mozgassa azt a készülékhez.
Tanulmány tulajdonságainak ammónia.
1. felfedezése oldhatóság, interakció vizes ammóniával. Erre a merülőcső ammóniával egy pohár vizet, és víz alatt, hogy nyissa azt, ábrán látható 22.3.
Mit nézel?
Anélkül, hogy a csőben van, zárja le a víz alatti dugót egy birtokos, majd tegyük egy állványt. Ehhez az oldathoz, adjunk hozzá 2-3 csepp fenolftalein-oldatot adunk.
Tedd reakcióegyenlet kölcsönhatást vizes ammóniával.
2. Nedvesítsen üvegrúd koncentrált sósavval, és a másik - a tömény salétromsav. Hogy azok alakulnak csövek ammónia. Mit nézel?
Tedd az egyenlet előforduló reakciókat.
Miért nem kap a tapasztalat a kénsav és foszforsav?
3. Öntse a kapott vizes ammónia-oldatot víz a két csövet. Az egyik csőbe, hozzáadunk néhány csepp fenolftalein-oldatot, és finoman dagály kénsavat, amíg a eltűnése az indikátor színe. Mit nézel?
Tedd egyenlet képződési reakciók szulfátot és az ammónium-hidrogén-szulfát.
4. A másik cső egy ammónia-oldattal, az oldathoz a vas-klorid (III). Mit nézel?
Record ionos reakció egyenletek.
ammónia előállítás:
A megfelelő pozícióban a cső alatti b). Először is, az NH3 könnyebb, mint a levegő, akkor megy fel, így szellőztető csövet kell irányítani felfelé. Másodszor, felhevíti az anyag egy kémcsőbe, így nem érintkeznek a kémcsőben, ami a tűz is elolvad.
A csövek száraznak kell lennie, mert az ammónia reagál vízzel képződésére ammónium-hidroxid.
A reakció termelő ammónia:
Az ammónia funkciók:
Ammónia igen jól oldódik vízben:
2.
3.
Az oldatot színtelenítjük, mivel a kénsav ammóniával semlegesítjük, azaz környezetben semlegessé válik. A semleges és savas környezetben fenolftalein színtelen.
4.
Mint Practice № 3. előállítás ammónia és tanulmányozása tulajdonságait. Bevezetés a tulajdonságait vizes ammónia?
Megtalálni a megoldást minden problémára
Oldalunk célja, hogy segítsen megoldani az oktatási problémákat, mint a problémamegoldás a fizikában. Itt jön, és megoldást találni a sajátos probléma, vagy találni egy hasonló, és megérteni, hogyan kell kezelni a pózoló. Minden diák segítségre van szüksége, mindenki keresi a legegyszerűbb módja, hogy a cél elérése érdekében, és mindig ott, hogy legyen kitartó és keresik.