Enzimek, mint katalizátorok
A folyamat az élet minden élő szervezet Sauveur-shayutsya bonyolult és változatos kémiai átalakulások különböző jellegű. A túlnyomó többsége, és amelyben a nem-adatok, akár az összes a kémiai reakciók az élő szervezetekben-max fordul elő a biológiai katalizátorokat - Fer-zsaruk. Ez magyarázza a könnyű áthaladását ezeket a reakciókat.
Enzimkatalízis jelentősen eltér a kémiai-ég katalízissel. Ezek a különbségek a következők.
A katalitikus aktivitás. Szerint a biológiai aktivitását a kata-rekuperátorok millió szor nagyobb, mint a tevékenység a kémiai katalizátor ka. Még a legjobb szervetlen katalizátorok - platina Atomic - rosszabb, például a kataláz enzimet gának ak-1 per aktív helyén ezerszer. Rate enzimreakciójának mérhető a következő példa: 1 mólnyi enzim képes megosztani szacharózt 1 1,000 mól cukorrépa.
Nyomokban enzimek hasítására képes hatalmas mennyiségű reagensek. Így 1 g kristályos pepszin hasítja a 50 kg-os koagulált tojásfehérjéből, és 1 g kristályos renin tekercs 72 tonna tej. A peroxidáz enzim, amely gyorsítja az oxidációt a szubsztrát miatt hidrogén-peroxid, fejti ki a hatását hígításban 1 tömeg. h. Az enzim a 500 millió tömeg. h. Víz.
Ajánlásai szerint a Nemzetközi Bizottság Enzimek nomenkla kerek-katalitikus aktivitását az enzim lehet jellemző a „molekuláris aktivitása”, amellyel úgy kell érteni, a molekulák száma a szubsztrát vagy egyenértékűségét-ing érintett csoportok per 1 perc átalakítja egy molekula enzim optimális szubsztrát-koncentráció.
Nagy kémiai jellegét. Ellentétben kémiai katalizátorok, enzimeknek sokkai nagyobb spe-fichnostyu: Mindegyik hat csak szigorúan meghatározott-Ing reakció vagy csoport reakciók zajlanak a szervezetben. Azt feltételezik, hogy az emberi test ugyanabban az időben a funkcionális, niruet mintegy 1000 különböző enzimek. Így alkotnak komplexet enzim rendszerek, amelyek egy élő sejt folyni számos szigorúan szekvenciális és Comp bagoly között reakciók. Ha enzimek nem volt ilyen magas specificitás vezetne gyors elbomlik tenni az összes anyagot a sejtekben, és a halál az egész szervezetre.
A specificitás enzimek oszlik abszolút (vagy vegyi anyagok) és sztereokémiái.
Abszolút specificitás - ez az intézkedés mindegyik enzim az anyag jól meghatározott kémiai összetételű. Például, ureáz enzimmel csak hidrolízisét katalizálja a karbamid, az enzim pepszin - csak szétkapcsoló fehérjék kataláz hat csak a hidrogén-peroxid.
A sztereokémiai specificitás, hogy fer-Ments hatnak csak bizonyos sztereoizomerjei szerves-ing vegyületek. Példaként az ilyen sajátosság, de rámutatnak a cselekvés két enzim: # 945; - és # 946-glükozidáz. Fer-rendőr # 945-glükozidáz aktusok csak # 945; -glyukozidy és # 946-glükozidáz - on # 946; -glyukozidy, amint látható az ábrán:
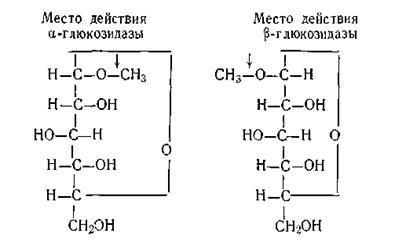
Az okok ilyen magas specificitását enzimek még nem teljesen tisztázott. Számos elmélet magyarázza a hatásmechanizmusa enzimeket.
Így a német vegyész Fischer megmagyarázni a sajátossága a enzim tekintetében ez a szubsztrát idején előre gested a hipotézist „zár és kulcs”. Ezen hipotézis szerint a szubsztrát molekula pontosan megfelel annak alakja egy bizonyos helyén a enzimmolekulában. Fisher véljük, hogy a „kulcs” - egy szubsztrátumot pont, de alkalmas az enzim - „vár” nélkül egyáltalán Naru-sheniya formák mindkét molekula. A vizsgálatok azonban azt mutatták, hogy bizonyos esetekben, Fisher hipotézis nem tudja megmagyarázni néhány tényt.
Annak érdekében, hogy ez az elmélet összhangba a kísérleti adatok Koshland némileg módosított modell a „kulcs - lock”. Szerint a hipotézis hordozó, csatlakozva az aktív centrum változtatja az alakját, így biztosítva tökéletes a korom-lelő. Más szóval, a funkciós csoportok esetében az aktív centrumban vegye specifikus térbeli konfiguráció csak akkor, ha azok erők jelenlétében al-réteg.
Így, kialakulása egy enzim-szubsztrát komplex tud végbemenni pro-elektromosan töltött miatt mindkét csoportban a enzim és a szubsztrát. Az ilyen csoportok lehetnek
Ennek eredményeként az ilyen kölcsönhatás a szubsztrát lehet proish-dit bizonyos kémiai módosításokkal ólom-B Rátérve mations új funkciós csoportok egy egészen más poláris tulajdonságokkal. A reakció befejeződése után, az enzim és a szubsztrát-szerű Ott bólint egymástól, és az enzim újra kész arra, hogy csatlakozzon az inter-akció egy másik molekula szubsztrát. A kémiailag módosított szubsztrátot hasít reakcióterméket.
Így a specifitása az enzim határozza meg a konfiguráció, a szerkezet és elektromos tulajdonságait az aktív csoportok az enzim.
Inaktiválása. Vprotsesse katalitikus reakció enzim fokozatosan összeesik, és elveszti aktivitását. Ezt a jelenséget nevezzük inaktiválása. A tapasztalat azt mutatja, hogy van nagyobb aktivitással enzim, így több időt szétmálló katalízis során. Ez a tulajdonság az enzimek meglévő tag-venno eltérnek szervetlen katalizátorok, amely, mint már említettük, változatlan marad a reakció termékek.
A szerkezet a enzimek. Összehasonlítva szervetlen katalízis-Tori enzimeknek sokkai bonyolultabb szerkezetű. Minden enzim fehérjét tartalmaz, és amely annak köszönhető, hogy a nagy specifitást biológiai katalizátorok. Szerint a szerkezete enzimek vannak osztva két nagy csoportra: egykomponensű és kétkomponensű. Ahhoz, hogy tartalmaz egy egykomponensű Fermi akkor, amely csak fehérje testek, amelyek hengerelt-iai tulajdonságú. Ezek az enzimek aktív szerepet csoportokat, kitölti bizonyos kémiai csoportok alkotják a fehérjemolekula, és kapta a nevét az aktív centrumban.
Jelenleg több mint 100 ismert egykomponensű-fer zsaruk
lucheno kristályos formában.
Két komponens közé tartoznak azok az enzimek, amelyek állnak a ny-fehérje és a nem-protein rész nevezett prosztetikus csoport. aktív prosztetikus csoport megkérték, hogy az úgynevezett HÉA Agon, és a protein hordozó - Feron vagy más módon apoenzim. Tanulmányok kimutatták, hogy a fehérje egy részét egy kétkomponensű enzim (Fearon) meghatározó befolyása van a hatása nem specifikus;. Azonban, az aktív vegyület a csoport egy protein vezet hatalmas növekedése a katalitikus aktivitás.
Azt is kimutatták, hogy a kötési szilárdságát Agon és Feron-CIÓ idő különböző enzimek. Egyes enzimek, mint például dehidrogenázok oxidációjának katalizálására különféle szubsztrátok, NY hidrogén visszavonás (dehidrogénezés) ez a kapcsolat törékeny-CIÓ. Ilyen enzimek könnyen disszociál, és szétesik Agon és Feron. A javaslatot a prominens francia biokémikus G. Bertrand, gyötrelem, könnyen elválik a fehérje része a farm-ta, úgynevezett co-enzimekkel.
Példaként említhetjük két komponens enzim piruvát-dekarboxiláz enzim, amely hasítja a piroszőlősavat acetaldehid és a szén-monoxid (IV):
A kémiai természete az aktív csoportot a piruvát-dekarboxiláz most teljesen tisztázott. Ez egy olyan vegyület, a molekula a B1-vitamin és a két aminosav a foszforsav Kitty tételek. Ez egy példa a piruvát-dekarboxiláz enzim ac-tive csoport, amelynek vitamint tartalmaz. Mint látható Fedezze fel a Bani-vitaminok szerves része számos fontos enzimek (kataláz, peroxidáz, stb.)
Befolyásolja a külső körülmények. Természetüknél fogva, enzimekkel-telno jelentős sokkal érzékenyebb a külső körülmények változását, mint a szervetlen katalizátorok. Különösen a „munka” enzimek sokkal szűkebb hőmérséklet-tartományban. A hőmérséklet optimuma a legtöbb növényi enzimek 313-333 K, hasa-TION enzimek 313-323 C. Ha a hőmérséklet túllépi az előre-ly, enzimaktivitás gyorsan csökken, és a 343-353 K jelentése a visszafordíthatatlan pusztulását okozta a protein denaturálódását-CIÓ. Csak nagyon kevés enzimek képesek meghatározni-CIÓ feltételek ellenáll a hő akár 373 K veszteség nélkül eszköz-ség.
Szervetlen katalizátor, a tapasztalat azt mutatja, a melléktermékek dolgozó személy magasabb hőmérsékleten - akár FIR MULTI-száz fok.
Ellentétben a szervetlen katalizátorok, enzimek megnyilvánuló aktivitásuk szempontjából a nagyon speciális pH tartományban. Táblázat. 2.1 ábra a pH-érték, amelynél az időben személyes enzimek fejtik ki maximális aktivitás.
Amint az a táblázatból látható, a pH-érték tartományban nagyon shi rock az aktivitását különböző enzimek. A pH hatása enzimaktivitás változása miatt a ionizációs állapotainak nemcsak az enzim és a szubsztrát önmagában, hanem az enzim - szubsztrát komplex.
A különböző enzimek különböző optimális pH.
Enzimek különböző / termények különböző optimális pH-értékek:
Rice 4.5 A búza, 6,0 Általánosságban elmondható: Vkat. = F (T, pH) A kinetika biokémiai reakciók által leírt Michaelis - Menten egyenlet. Michaelis és Menten tanulmányozta a reakció sebességét az ATP hidrolízis által miozin. Fehérjék aktin, miozin és az ATP döntő szerepet játszanak az izom-összehúzódás folyamatát. ATP hidrolízis → ADP + F + E E - Az energia felhasználása az izom-összehúzódást. ATP - szubsztrát (reaktáns); ahol # 965; 0 - eredetileg reakció sebességét; # 965; 0max - elméletileg meghatározott kezdeti reakciósebesség a szubsztrátum koncentrációk max; S0 - kezdeti szubsztrát koncentrációja; KS - mint szubsztrát koncentráció, amelynél: # 965; 0 = ½ # 965; 0max 1) alacsony függőség S0 # 965; 0 = f (S0) lineáris (reakció engedelmeskedik az egyenlet # 921; - sorrendben); 2) ha S0 »KS reakció nulladrendű a szubsztrát koncentráció, t. E. A kezdeti sebessége független a szubsztrátum koncentráció, telítődés következik be.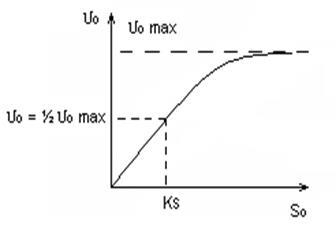
Kapcsolódó cikkek