Típusú kémiai kötések
Kovalens kötés - két atom közötti kötést, amelyek össze vannak kötve egymással a kialakulását Általános elektronpár.
Két lehetséges képződésének mechanizmusát a közös elektronpárt:
· Csere mechanizmusa, ha minden egyes a kölcsönható atomok biztosít egy pár egy elektron,
· Donor-akceptor mechanizmus. Ha az egyik atom nyújtó egy elektronpár, és a másik - az üres (szabad) orbitális.
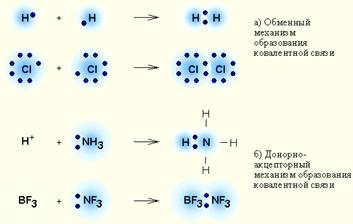
# 8252; A donor-akceptor mechanizmus vannak kialakítva, mégpedig a következő anyagok:
1. Minden komplexek;
4. Gázok CO - szén-monoxid, O3 - ózon.
Elektronegativitás (EO) - atom képes vonzani elektronokat a kialakulása egy kémiai kötés. Így, egy elektron kényszerült, hogy egy atom az elem, amely egy nagy elektronegativitása.
Három eset lehetséges a két a és b atomok egy kötést képez: AB
1) EO (A) = EO (B) (a különbség elektronegativitási nulla).
A teljes elektronpár nem tolódik bármely atomok. Nincs pole, az elektronsűrűség az atomok mind az azonos.
Ez NEPOLYaRNAYakovalentnaya kapcsolatot.
# 8252; Példák a nem-poláris kovalens kötés: a) kétértékű egyszerű anyag. H-H, F-F,
b) Szimmetrikus molekulák, például a H2O2 (H-O-O-H) - közötti kapcsolat a két oxigénatomot és hasonlók ..
A kovalens kötés elektronpár eltolódik a több elektronegatív atommal egy rajta tűnik részlegesen negatív töltéssel, és B - részleges pozitív.
Az ilyen kötés az úgynevezett kovalens polaritású.
# 8252; Ez a típusú csatlakozás jellemző molekulákat (vagy csoportok), amelyek két vagy több nem-fémek (HCI, H2O, CH3COOH).
Minél nagyobb a különbség EO, annál nagyobb a bekötési polaritást (az elektron pár tartozik mindkét atom). Például, egy sor HCI à HBr à HI bekötési polaritást csökken.
3) EO (A) >> EO (B).
Elektronegativitás különbség olyan nagy, hogy az atom a (fém) adja a elektron az atom (nonmetal). Ott ionokat - kation és anion B + A.
Az ilyen kötés az úgynevezett ION.
Ion Svyaz korlátozó esetében a poláris kovalens kötés.
# 8252; Ez a típusú csatlakozás jellemző vegyületek származó fémek nemfémek, fém-oxidok, bázisok és sók, beleértve a szerves sók és ammónium-sók.
Egy ionos kristály molekulák ott. Minden ion körül egy bizonyos számú ionok ellenkező előjelű.
Az ionos kötés jellemzi nem irányított és telítetlen. Rendelkező anyagok ionos kötések ionos kristályrácsban.
# 8252; szabad elfelejteni, hogy vannak olyan anyagok a molekulában, amelyek egyszerre vannak jelen, és az ionos és kovalens kötések (például nátrium-hidroxidot, KNO3).
3. A fémes kötés keletkezik egyszerű anyagok - fémek közötti pozitív töltésű fémionok és a szabadon mozgó elektronok ( „elektron gáz”). A jelenléte az ilyen szabad mozgás az elektronok az oka a jó hő - és a villamos vezetőképessége fémek.
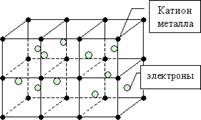
fématomok eltér az atomok más elemek, amelyek viszonylag gyengén tartsa a külső elektronok. Ezért, az elektronok az atomok, ezek átalakítása pozitív ionok. „Társadalmasítása” az elektronok közötti térben a fémionok és tartsa őket.
A hidrogénkötés - a kötés nincs a molekulában, és molekulák közötti vagy részeinek molekulák közötti független.
A hidrogénkötés - között keletkezik erősen elektronegatív atom (rendszerint hidrogénatom vagy fluoratom, legalább a nitrogén) és a hidrogénatom a másik molekula vagy molekularész:
(Solid bar jelentése kovalens kötés, rámutat - hidrogénkötés).
A hidrogén jelenléte kötések vezet rendellenesen magas forráspontú anyagok is, amelyben jelen van.
Forráspont hőmérséklet a hidrogén csoportok a vegyületek nemetallovVIA
Az oxidáció mértéke - hipotetikus töltéssel rendelkező atom a molekulában, feltételezve számítják ki, az ionos jellege kötést és az a tény, hogy az egész molekula elektromosan semleges.
A hossza a energia (szívósság) és a polaritás a kapcsolatot.
A kötés hossza - közötti távolság az atommagok az atomok a vegyület.
A) sugara az alkotó atomok a kötést
B) a kommunikációs multiplicitás (egy-, két-, három).
Általában, minél nagyobb a kapcsolási hossza, a kevesebb energiát (szívósság).
Kommunikációs tartják, hogy erős, ha az energia meghaladja az 500 kJ / mol (például, 942 kJ / mol N2), gyenge - ha annak energia kisebb, mint 100 kJ / mol (például, 69 kJ / mól és NO2).
Ha az atom kötődik más atomok azonos kötésekkel, de kialakulásukat magában különböző pályák, akkor használják hibridizációval.
Példa: CH4 molekula alakja egy szabályos tetraéder benne minden csatlakozás 4 azonos hosszúságú, szilárdság, amelyek azonos szögtávolságban egymással.
Azonban tetravalens szénatom elektronok vannak elrendezve három p pályák és egy s-pályák. Ezek különböző energetikai formában vannak elrendezve egy helyet egyébként.
Hogy magyarázza a koncepció hibridizáció használjuk:
4 kialakítva négy új atomi pályák,
hibrid pályák, amelyek székhelye a tér maximális távolságra egymástól. Ez egy szabályos tetraéder, kötés szögek 109 ° 29' .
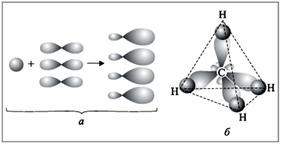
Mivel a kialakulását a négy hivatkozások részt egy s és három p-shell, akkor ez a fajta hibridizációs jelzi sp3
Attól függően, hogy a számát és típusát pályák, hogy részt vegyenek a hibridizáció, hibridizációs megkülönböztetni a következő típusok:
1) SP-hibridizáció. Részt egy s-orbitális és egy p-orbitális. A molekula lineáris szerkezetű, vegyérték szög - 1800.
2) sp2-hibridizáció. Részt egy s-orbitális és két p pályák. A molekula található egy síkban (a végeket hibrid pályák vannak irányítva, hogy a csúcsai egy egyenlő oldalú háromszög), kötésszög - 1200.
3) sp3-hibridizációs. Részt egy s-orbitális és három p pályák. A molekula tetraéderes formában, kötésszög - 109,280.
4) sp3d-hibridizáció. Az alakja a molekula - egy trigonális kettős gúla.
5) sp3d2-hibridizáció például - SF6. Az alakja a molekula - az oktaéder.
Hogyan állapítható meg, hogy milyen típusú hibridizáció?
1. A hibridizációs magában szigma-kötés és egy osztatlan ionpárokat.
2. Az összes résztvevő pályák - meghatározza azokat a hibridizáció.
Feladat: Annak meghatározására, hogy milyen típusú hibridizáció szénatom a molekulában foszgént.
1) 2 formák szén egyszeres kötés (a szigma-kötés) és egy kettős kötést (Sigma + pi) .Minden 4 szénatomos elektron részt vesz a Ezen kötések kialakulását.
2) oly módon, hogy részt vegyen hibridizációs három szigma-kötés. Ez SP2 hibridizáció. molekula formájában egy lapos háromszög. Pi-kötés síkjára merőleges a háromszög.
Test kérdésre anyag szerkezete.
1. Milyen mechanizmusok a kovalens kötés? Milyen kapcsolat hívjuk kovalens?
2. Mi a különbség a kovalens kötés ionos?
3. Mi a vegyértéke? Által meghatározott vegyértéke atomok?
4. Tegye a atomok nem vegyértékével egyenlő a legnagyobb számú a csoport?
5. A polaritás a csatlakozás - mi tényezők határozzák meg?
6. Melyik anyag a legnagyobb mértékű ionos jellege?
7. Mi a fémes kötés?
8. Mik a tulajdonságai fémek társított fém típusú kommunikáció?
9. Ha van egy hidrogénkötés? Hogyan befolyásolja a az anyagok fizikai tulajdonságai?
10. Milyen tényezők erősségétől függ, és hossza a kommunikáció?
11. szigma és pi-kötés. Különbségek és funkciók.
12. típusai hibridizációja pályák a szerves és szervetlen anyagok. Az alakja molekulákat különböző típusú hibridizáció.
13. A típusú kristályrétegeiben. Jellemzők tömbök különböző típusai: erő, fizikai tulajdonságai.
14. donor-akceptor kötés - képződését jellemzők, anyagok, amelyekben jelen van.