Kemilumineszcencia Luminolos 2
Bizonyára, amit valaha láttam a ragyogás stick - izzás botok, amelyek kezdik munka után a „leszokás”. Belül - egy üveg kapszula, amely ebben az esetben lebontja és elkezdi valami misztikus kémiai reakció. Mindig kíváncsi arra, hogy hogyan működik.
A kötési energiája a molekulák során felszabaduló kémiai reakció - lehet elosztani a hő formájában (amit mi), de néhány esetben tovább is - formájában egy foton sugárzás. A kibocsátott fény alatt egy kémiai reakció az úgynevezett kemilumineszcenciás. Két leggyakoribb reakció kemilumineszcencia: Luminol oxidációs TCPO és oxidációval jelenlétében szerves festékek.
A különbség az, hogy maga a fény Luminol és TCPO - továbbítja energiát a molekulák a szerves festék (mint például a Rhodamine), és így lehet szabályozni kiválasztásával a festék színe lumineszcencia. Mintegy TCPO (beleértve a szintézis) megtekinthető a YouTube-ra (a használata szintézis), és a változat Luminol - a vágás.
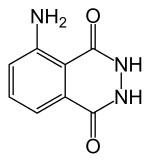
Először is - Luminol. Megtalálható a vegyészek fórumokon (1 2), vagy over the counter néven Galavit (nátrium-só luminol, ez a verzió még nem próbáltam). Találtam egy bolhapiacon
$ 1 grammonként. Ne légy mohó, 1-2-3 gramm elég lenne kísérletezésre.
Luminol oldjuk csak a lúgos környezetben - híján nátrium-hidroxid (NaOH) vagy a kálium-hidroxid (KOH). Eladva a kémiai termék (például Ruskhim).
Sok példát, amely megtalálható az interneten - a reakciót luminollal vizes közegben (hidrogén-peroxid beadagolást). De a fény ebben az esetben egy gyenge és nagyon rövid (néhány / több tíz másodperc). Sokkal jobb eredményeket lehet elérni, ha használt dimetil-szulfoxidban (DMSO), értékesítik a gyógyszertárakban néven Dimexidum oldószert. Amikor vele dolgozni, hogy legyen óvatos és viseljen kesztyűt - bár ő maga, és nem mérgező, de könnyen áthatolnak a bőrön, és magukkal viszik a vérből oldható szennyeződéseket a kezüket. Lehet, hogy egy könnyű szagot szennyeződések miatt, úgyhogy jobb, ha nem illata. Világos szín jellemzi az utat - a vízi környezet fénye kék DMSO - türkiz. Miért van az, - egy érdekes kérdés.
Mint egy oxigén forrása - a legegyszerűbb esetben lehet használni, légköri oxigénnel vagy gidroperit a gyógyszertárban. A hidrogén-peroxid nem lehet használni, mivel a víz van.
Végül a katalizátort - abban az esetben, DMSO nem szükséges, de megpróbálhatod variációk vérrel, hematogén és torma juice (!). Próbáltam, hogy a szárított vért, és a réz-szulfát - semmi jó lett belőle. Talán az egyetlen fontos katalizátora a reakciót a vizes közegben.

A fő nehézség -, valamint, hogy mit kell tenni mindent, hogy működjön? Beletelt sok kísérlet történt egy jól működő verziót.
Mint kiderült, hidroxid soha nem túl sok, és ez körülbelül a fele térfogatú DMSO, akkor is, ha nem oldódik. Luminol - tekintve mérkőzés fejek 1-2-3 100ml. A jelenléte oldatlan hidroxid pelletet - kulcsfontosságú tényező a kezdete a reakció. Fényesség - függ a hőmérséklettől, és az oldott oxigén. Anélkül gidroperita parázslás nagyon gyorsan marad csak a felületi réteg folyékony - ahol atmoszferikus oxigén:

Gidroperita 1g 100ml folyékony, és keverjük össze - fog világítani az egész mennyiség:

A ragyogás elhalványul fokozatosan, de még 30 órás reakcióidő még folyamatban van:

Az első keret - DMSO luminollal oldott kálium-hidroxidot és öntünk egy lombikba DMSO és kálium-hidroxid az alján. Ez a kísérlet azt mutatja, hogy szükség van egy KOH pelyhek nem oldott alján, hogy indítsa el a reakciót.
3:40 - luminol és a száraz KOH öntjük DMSO. Miután a reakció elindul.
6.19 - ugyanaz, mint az „általános” kapacitását.
Frissítés: Verzió nélkül gidroperita a barbotatsiey oxigént. Nézd a 40. a második, az oxigén - 2,09. Ebben az esetben - DMSO-ra melegítjük
60 fok, ami megnehezítette érdekes hatásokat konvekciós.