Entalpia - studopediya
A matematikai kifejezés első főtétele
A törvény kimondja, hogy egy elszigetelt rendszerben az összeg minden formájú energia állandó.
Ezt szem előtt tartva, a matematikai kifejezés, az első főtétel differenciális formában 1 kg munkaközeg van írva a következő formában:
ahol q - a hő átadódik a munkaközeg, u - a belső energia a munkaközeg, l - a munkát a terjeszkedés.
Mivel a jobb oldalon a matematikai kifejezés, az első főtétel elemi munka teljes eltérés, akkor az elemi hőt a bal oldalon is, nem lehet a teljes eltérés állapot paramétereit. Ezért, az elemi hő termodinamika is elfogadott, mint az elemi nyomó jelölt szimbólummal # 948;.
Miután integráció kapjuk a következő kifejezést:
Itt a hőség, valamint a 1.2 indexek jelzik, hogy a hő is függvénye a folyamat.
Az első főtétele olvassa, foglalta össze az energiát a munkaközeg hő formájában fogyasztják a változás a fajlagos belső energia a test, és hogy ezt a művet.
feltéve, hogy # 948; L = P dv. felírhatjuk:
# 948; q = du + P dv, [J / kg].
Az első forma a differenciálegyenlet az első főtétel egy kg alkalmazott munkafolyadék zárt rendszerekben: a belső égésű motor hengerek, egy dugattyús kompresszor.
Számos készítmények első főtétele:
1. Energiyane fakad „semmi”, és nem pusztul el a „semmi” .Teplovaya vagy mechanikai energia nem merül fel a semmiből, vagy alakulnak semmit.
2. Bármely forma mozgása, és képesnek kell lennie arra, hogy átalakíthatók bármilyen más alakú energii.Oni lehet alakítani kölcsönösen egymásba csak ekvivalens mennyiségben.
3. Perpetuum mobile első fajta nem lehetséges (pl. E. Nem a „semmiből”, hogy nem munka).
1755-ben a Francia Tudományos Akadémia bejelentette, hogy többé nem vesz tudomást örökmozgó projektek.
A hatalmas mennyiségű hőteljesítménye hőszolgáltató járunk el különböző munkaközeggel nyitott rendszerekben állandó nyomáson (gőzkazánok, égéskamrák gázturbinák és hajtóművek, hőcserélők), valamint számos folyamatok kémiai technológia és még sokan mások. A 19. században fizikus Gibbs függvény bevezetett termikus számítás, amely később az úgynevezett entalpia. Az entalpia használják gyakrabban, mint a belső energia, emiatt a táblázatok termodinamikai tulajdonságainak entalpia gyakran, de nem a belső energia. Entalpia betűvel jelöljük I (vagy alkalmanként H), és képviseli az összege az energia belső U a rendszer, és a rendszer nyomása p a termék térfogata V:
Óta tag értékek-a állami funkciók, akkor, valamint a belső energia, entalpia egy állami funkciót. Csakúgy, mint a belső energia, pa-bot és a meleget, ez mérik Jow-Lyakh (J).
Fajlagos entalpia jelöljük i (vagy H), levelet t.e.mozhno
i = u + p • v. [KJ / kg] (3)
Termék p • v - a munka, amit meg kell fordított, hogy a gáz térfogata v a környezetben a P nyomás, azaz P • v - a potenciális energia a gáz.
Differenciálás (3): di = du + P dv + v DP és tekintettel arra, hogy
# 948; q = du + p • dv,
di = # 948; q + v · dP, (4)
Így a fajlagos entalpiája nagyobb külső hő foglalta egy művelet összegét v • A DP.
Expression (4) gyakran írják:
# 948; q = di - v · dP, (5)
Expression (5) jelentése egy második formája a felvétel az első főtétele.
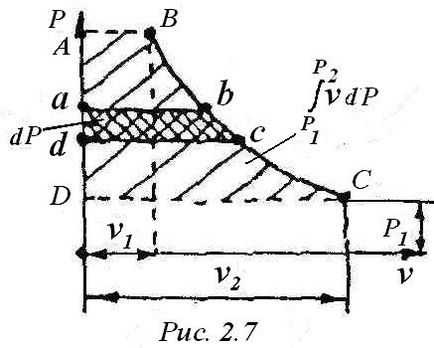
Az érték v • dP munka a grafikonon (2.7 ábra) az a terület, AB da .A (3), hogy a két kifejezés a jobb teljes differenciálművek tehát, izo-, és a teljes differenciál entalpia - állami funkció. Ezért integrálása után a kifejezést (4) van:
Entalpia számított, nulla, amelyre annak értéket veszi hőmérsékleten 0,01 ° C, és a nyomás P = 610,8 Pa, és az ideális gázok O ° C-on a nyomás függvényében. Mivel az entalpia és a belső energia ott van a fenti összefüggés, a választás a származási egyikük nem önkényes: a lényeg hozott, mint a származás a belső energia, u = 0, egy i = pv. Ezért, például, a víz t = 0,01 ° C, és P = 610,8 Pa = 0, és i = PV = 610,8 # 8729; 0,001 = 0,611 J / kg.
A differenciál entalpiája egyenlő
ahol cp - tömeges igaz fajhője állandó nyomáson, T - a hőmérséklet a munkaközeg.
Gyakorlati számítás, valamint a belső energia, entalpia határozza növekmény
ahol az átlagos fajhő állandó nyomáson egy hőmérséklet-tartományban a T1 és T2.
A méretei a belső energia és entalpia a munkafolyadék ugyanaz, mint, hogy a hő és munka - J vagy utalás a kg a munkaközeg - J / kg.