Szintézise és bomlása glikogén
A humán és állati sejtek, glikogén az az energia tartalék anyagot. Különösen sok ez a májban és az izmokban. Egy felnőtt teste tartalmazhat legfeljebb 450 gramm glikogén.
A glikogén szintetizálódik az emésztő időszakban (1-2 órával a bevétel után szénhidrát). Szintézise glikogén szintézist, mint olyan eljárás energiát igényel. Glükóz belépő a sejt foszforilált, formák glükóz-6-foszfát-eredményeként. Katalizálja a folyamatot az enzim - hexokináz. Továbbá, glükóz-6-foszfát, az enzim által - foszfoglükomutáz glükózzá alakul 1-foszfát, amelyet azután az enzim által UDP-glükóz alakítjuk UDP-glükóz. Ez a reakció részvételét igényli új, nagy energiájú vegyületek - UTP (a reakció irreverzibilis). Mivel glikogén a cellában soha nem szabad hasítjuk teljesen, a glikogén szintézis végezzük kiterjeszti a már meglévő glikogén nevű molekula „primer”, amely 4 vagy több glükózt maradékok, például a rövidebb fragmensek „nem felismerhető” enzim, és a folyamat a glikogén szintézis megállítja, hogy végső soron a test halálát.
Alkalmazott szubsztrát lánchosszabbítási glikogén UDP-glükóz. A szerepe „mag” is végezhet glikozidáz különböző polimerizációs fokú, vagy fehérje prekurzora, amely egy előre-kötésű glükóz egységek. Katalizálja a lánchosszabbítási folyamat a fő szabályozó enzim, a glikogén szintézis glikogén - glikogén.
Glikogensintetazy kiterjeszti redukáló ága glikogén képződése # 945; -1,4 glikozidos kötés, amíg ez az áramkör nem lesz, amíg az elágazási része legalább 11 glükóz maradékokat. Ezt követően hatályba lép az úgynevezett „elágazó” enzimet. Ez átvitelét katalizálja a terminális oligoszaccharid-fragmens, amely 6-7 glükóz-maradékok a nem redukáló végén a lánc, számozás legalább 11 glükóz maradékokat ebben a belső egyensúlyát glükóz vagy más lánc képződhetnek a helyén 1,6-glikozidos kötés, és így a megjelenése új elágazás. Ezt követően, a glikogén képes új glükóz egységek az oldallánc.
A fő vagy elsődleges bomlás glikogén glikogén foszforizáló vagy glikogenolízis. A glikogén lebontása hatására végbemenő növekedést a szervezet szükségességét glükóz.
Kezdetben, az intézkedés alapján glikogén aktív (foszforilált) glikogén elhasadó glükóz-1-foszfát. Az eljárást szervetlen foszfátot. Csakúgy, mint a szintézis, lebontása glikogén kezdődik nem redukáló poliszacharid ágak. Glikogénfoszforiláz és újra támad, nem redukáló ág glikogén-ig, amíg elér egy olyan pontot, amely fel van bontva a négy glükóz egységek # 945; -1,6-glikozid kötés. Itt az enzim hatására leáll. Ezt követően, a glikogén ebben a részben kezd működni az úgynevezett „elágazást megszüntető” enzim két különböző enzimaktivitások - transzferáz és glükozidáz. Az első három ezen enzim megmaradt, amíg a glükóz maradékot átvisszük elágazási pont nemredukáló bármely ága, kiterjesztve azt. Fennmaradó egy elágazási pont glükóz maradékot további hidrolitikusan lehasítjuk, így szabad glükóz. Termék fellépés glikogén foszforiláz - glükóz-1-foszfáttá alakítjuk foszfoglükomutáz alakítható glükóz-6-foszfátot. Továbbá, glükóz-6-foszfát-benne van a katabolizmus vagy más metabolikus utak. A májsejtek, ez lehet hidrolizálni az enzim által a glükóz-6-foszfatáz, hogy szabad glükóz, amely ezután a vérbe. A vázizom, ez az enzim hiányzik, azonban a glükóz-6-foszfát által használt izmok energia alatt katabolizmus glükóz - glikolízis.
A rendelet a glikogén szintézis és lebontás végezzük kölcsönösen. Reciprok szabályozás azt jelenti, hogy egy és ugyanazon keresztmetszeti szabályozó hatását az enzimek glikogén-szintáz és a glikogén foszforiláz (foszforiláció vagy defoszforiláció) aktiválását okozza az egyik ilyen enzimek inaktiválása szinkron másik. Intenzitásának szabályozására foszforiláció-defoszforiláció folyamatokat a sejtek - hormonok (inzulin, glukagon, adrenalin). Például, a keresztmetszeti foszforilációja glikogén és a glikogén foszforiláz aktiválását eredményezi, és inaktiválása glikogén glikogén-foszforiláz, így a kezdete a bomlási folyamat glikogén szintézis és megállás az utóbbi.
Hasnyálmirigy - inzulin fokozza defoszforiláció folyamatok a sejtek, így tart folyamatok a glikogén lebomlását és fokozza annak szintézisét. A májsejtek, inzulin indukál glükokináz szintézissel - az enzim, amely katalizálja a glükóz-6-foszfát, amikor a vér glükóz koncentráció magas. Ezért, a máj glikogén-szintézist aktivált bizonyos idő után az étkezés tartalmazó szénhidrátok.
Az antagonisták biológiai hatása az inzulin, glukagon és adrenalin kaszkád mechanizmusok erősítése foszforilációs folyamatok a sejtekben, ezáltal növeli a glikogén lebontást és gátolják bioszintézisének.
Mivel a máj sejtek kivételével # 946; 2-adrenoceptor szintén # 945; 1-adrenoceptorok, hogy az adrenalin van a képességét, hogy fokozza a glikogén lebomlását segítségével erre a célra ionok a kalcium (Ca +2 aktiválja -kötő fehérjék és, végső soron, foszforilezését növelő eljárások).
A harántcsíkolt izom foszforiláz-kináz enzimet Meg funkciók az enzim kötőhelyet tartalmaz kalciumionokat.
Amikor a koncentráció mellett a kalciumionok a szarkoplazma izom-összehúzódás, amikor a kalcium-ionok kötődnek foszforiláz kináz és aktiválja azt. Ennek eredményeként, a munka felgyorsult glikogén lebontását a glükóz-6-foszfát és az utóbbit használják energia a folyamat a glikolízis. Az energia az ATP használjuk a munka elvégzésére az izmokat.
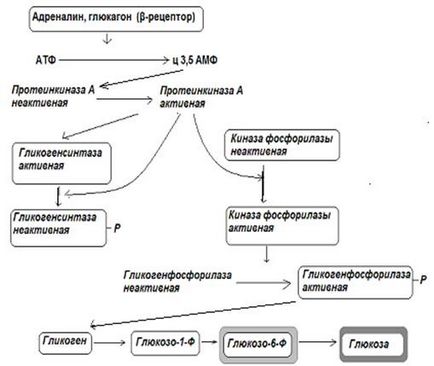
Ábra. 12-1. Rendelet és a szintézis bomlás glikogén a májban glukagon és az adrenalin.
(P- csoport foszforsav)
Glikogenosis - örökletes betegségek által okozott hibás részt vevő enzimek glikogén metabolizmus.
A glikogén tárolási betegség I. típusú (I. típusú) - ok - egy örökletes hiba glükóz-6-foszfatáz. Gierke betegség nyilvánul hipoglikémia, megemelkedett vér trigliceridszint, hiperurikémia (a húgysav a vérben). Lehetséges acidózis.
Pompe-kór - alacsony aktivitás vagy hiánya lizoszomális # 945; -1,4 és # 945; -1,6-glikozidázzal. Ennek eredményeként kezd felhalmozódni a lizoszómáiba glikogén.
Forbes betegség vagy Corey (III típus) meglehetősen resprostranena. ¼ minden esetben a máj glikogén. Kumulált glikogén kóros mert hibás „elágazást megszüntető” enzim. A hiányzó glükóz a vérben mutatja gyorsan. Ellentétben glycogenosis I. típusú, és tejsavas acidózist nem jelölték hyperurikaemiás.
Andersen-féle betegség (IV típus) - ritka. Ebben a betegségben az alacsony vagy hiányzó aktivitása „elágazó” az enzim. A betegség gyorsan fejlődik, és gyakorlatilag kezelhetetlen.
Betegség Mack Ardley (V típusú) - nyilvánvaló hiánya az izmok glikogén. A betegek nagyon kis tolerancia izom terhelés.
Hersey Disease (VI típus) - nyilvánul által okozott tünetek májbetegség. Ez a glikogén - következtében a hiba glikogénfoszforiláz. Májsejtekben felhalmozódnak glikogén normális szerkezetét.
Tardy betegség (VII típus) hibája miatt foszfofruktokináz enzim eritrocitákat és harántcsíkolt izomzatban. A betegek végezhet csak mérsékelt testmozgás.
Ritka glikogenosis is köszönhető, hogy hibák a fejlődő enzimek: a protein kináz A, foszforiláz-kináz, és a fosfoglitserolmutazy M alegységének laktát-dehidrogenáz.
Glikolízis - ahogy a glükóz lebontását az alábbiak szerint:
I - path energizáló sejtek. A sejteket működő anaerob körülmények vagy hiányában mitokondriumok az egyetlen előállítására szolgáló eljárás energia formájában ATP.
II - néhány metabolitjai glikolízis lehet használni a bioszintézis az esszenciális aminosavak és a lipidek (PVK, dihidroxi-aceton-foszfát).
A glikolízis lehet megkülönböztetni 2 fázisok:
1. Az előkészítő szakasz, amelynek során a glükóz foszforileződik és hasad két molekula phosphotriose. Ez a sorozat a reakciók végbe a kiadási két molekula ATP.
2. lépés konjugátum ATP-szintézis. Ennek eredményeként ez a sorozat a reakciók phosphotriose alakítjuk piruvát. A felszabaduló energia ebben a lépésben szintéziséhez használt ATP.
Az első szakasz kezdődik, a glikolízis a glükóz foszforiláció reakciók részvételével ATP, magnézium-ionok és az enzim hexokináz. A májsejtek, van egy másik fajta hexokináz, az úgynevezett glükokináz. A glükokináz, ellentétben a hexokináz, egyedi csak az a D-glükóz, a glükóz-6-foszfát nem érte-inhibitor, egy magas K értékét m, ami növeli a glükóz koncentrációja a májsejtekben a foszforilezett formában, ennek megfelelően, hogy annak szintje a portális keringésben .
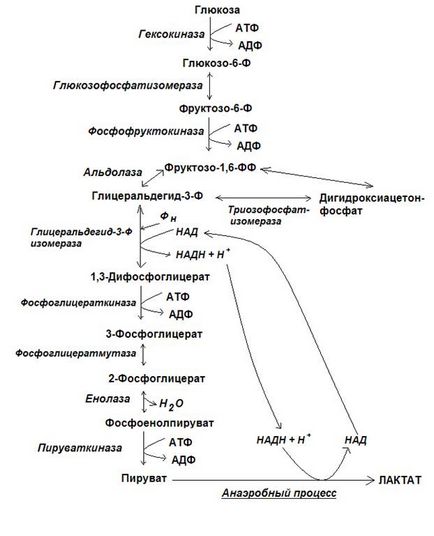
A második reakció - izomerizációs reakció: glükóz-6-foszfát-alakítjuk fruktóz-6-foszfát által az enzim glyukozofosfatizomerazy. A reakció reverzibilis.
A harmadik reakció - irreverzíbilis reakció - a reakció a második foszforiláció a kiadási ATP, és ez a folyamat katalizálja fő szabályozó enzim, a glikolízis - -1 foszfofruktokináz (PFK-1). Ez az enzim a felszínén 7 és 12 kötőhelyeket. Az aktivált PFK-1 nagy koncentrációban ADP-t és, különösen, AMP, és gátolta: nagy koncentrációjú ATP, citrát, szabad zsírsavak.
A negyedik reakció - hasítási reakcióját fruktóz-1,6-difoszfát végzi az enzim aldoláz. A reakció reverzibilis. A reakció során termel két trióz-foszfát - gliceraldehid-3-foszfát és dihidroxiaceton-foszfát.
Az ötödik reakció - izomerizációs reverzibilis reakció történik az intézkedés alapján az enzim trióz-foszfát-izomeráz. A reakciót felé tolódik kialakulását gliceraldehid-3-foszfát, mint az utóbbi folyamatosan és könnyen részt a további átalakításokhoz. Így lehet önkényesen feltételezni, hogy az első lépés a glikolízis teljessé a kialakulását egy molekula glükóz két molekula gliceraldehid-3-foszfát.
A második lépésben a glikolízis a 2 molekula gliceraldehid-3-foszfát keletkezik: 2 PVK-molekula, 2 molekula NADH + H + és 4 ATP.
Hetedik reakció - reakciót a szubsztrát foszforiláció közvetíti egy enzim - foszfoglicerát - 1,3-difoszfoglicerát reagáltatunk ADP és az ATP előállított, és a 3-foszfoglicerát.
Nyolcadik reakció - az intramolekuláris helyettesítési reakciót végezzük foszfoglicerát-mutáz enzim. A reakció során, míg a foszforsav maradékát 3 mozog a második helyzetbe, és van kialakítva a 2-foszfoglicerát.
Kilencedik reakció - a reakció a kiszáradás. Ennek eredményeként ezt a reakciót elő 2-foszfoglicerát makroenergeticheskoe vegyületet - foszfoenol (PEP). Enzim reakciót katalizáló - enoláz.
Tizedik reakciót - a reakció a második szubsztrát foszforilezését. A reakció irreverzíbilis. Katalizálja a folyamat enzim - piruvát kináz. A sorsa a csökkentett NAD és STC termelt glikolízis attól függ, milyen állapotban a sejt - aerob vagy anaerob. Anaerob körülmények között STC csökken tejsav felhasználásával során képződött glikolízis, NADH + H +. NAD ezután visszavezetjük az eljárásba, és így, nem szakad glikolízis (glikolitikus oxidoredukció).
Aerob körülmények között kapott glikolízis során piroszőlősav mitokondriumok általánosabb módon a katabolizmus nem bomlik, CO2 és H2 O, energiát adó (ATP).
NADH + H +. által alkotott oxidációja gliceraldehid-3-foszfát a folyamat aerob glikolízis oxidáljuk átadása hidrogénatomok a mitokondriális légzési lánc. Azonban citoszol NADH + H + nem képes átvinni a hidrogén a légzési lánc, mert lánc mitokondriális ér impermeábilis. Az átadás a hidrogén a membránon keresztül történik keresztül konkrét közlekedési rendszerek, úgynevezett transzfer. Ezekben a rendszerekben, a hidrogént a membránon keresztül szállított segítségével pár szubsztrátok csatlakoztatott releváns dehidrogenázok. Két transzfer rendszer.
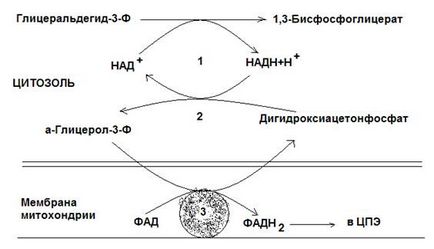
Ábra. 12-3. Glicerofoszfát transzfer rendszer.
2 - glicerin-3-foszfát-dehidrogenáz (citoszolikus nevezett enzim fordított reakció);
3 - glicerin-3-foszfát-dehidrogenáz (mitokondriális enzim).
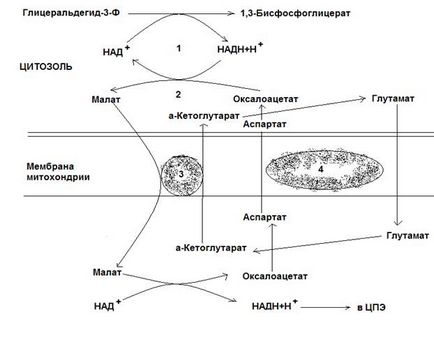
Ris.12-4. Malát-aszpartát inga rendszer.
Az első ilyen rendszerek hidrogénatom citoszol NADH továbbított dihidroxi-aceton-foszfát, az enzim által a glicerin-3-foszfát-dehidrogenáz (NAD-függő enzim, az úgynevezett fordított reakció). Során képződő e reakció, a glicerin-3-foszfát-oxidáljuk több belső mitokondriális membrán enzim - a glicerin-3-foszfát-dehidrogenáz, FAD-dependens enzim). Ezután, a protonok és az elektronok mozogni a FADN2 ubikinon és tovább mentén elektrontranszport lánc (CPE).
Glitserolfosfatnaya transzfer rendszer működik a sejtek a fehér izom és májsejtekben.
A második továbbító rendszer, amely magában foglalja a malát citoszol és mitokondriális malát-dehidrogenáz, sokoldalúbb. A citoplazmában NADH helyreállítja oxálacetáttá a malát, amelyek segítségével a hordozó zajlik a mitokondrium, amely oxidálódik oxálacetáttá NAD-függő malát-dehidrogenáz. Újrahasznosított során ezt a reakciót NAD ad hidrogénatom mitokondriális CPE. Azonban kialakított malát oxálacetáttá visszavonja magát a mitokondriumok a citoszollai nem lehet, mert a mitokondriális membrán átjárhatatlan neki. Ezért oxálacetát alakítjuk aszpartát, és bejut a citoszolba, ahol oxálacetáttá újra. Átalakítása oxálacetát be aszpartát és fordítottan a csatlakozással kapcsolatos, valamint a hasítási amino (transzaminációs reakció). Ez shuttle rendszer úgynevezett malát-aszpartát. Az eredmény az ő munkája - regeneráció a citoplazmatikus NAD NADH.
Transzfer rendszerek eltérő összegű szintetizált ATP. Az első rendszer az arány a P / D jelentése 2, mivel a hidrogént vittünk be a CPE KoQ szinten. A második rendszer több energia hatékonyabb, mivel a hidrogén CPE keresztülhalad mitokondriális NAD és aránya a P / D közel van a 3.
A anaerob glükóz oxidációját ATP képződik - két molekula.
A aerob glükóz oxidációját ATP hozam 38 ATP (malát-aszpartát mechanizmus) vagy a 36. ATP (# 945; -glicerin-3-foszfát-mechanizmus).
A szabályozás a glikolízis végezzük megváltoztatásával aktivitását számos szabályozó enzimek -1 foszfofruktokináz (PFK-1), piruvát-kináz, hexokináz.
PFK-1-aktivitás fokozott: növekvő koncentrációjú ADP és AMP, fruktóz-2,6-difoszfát, és csökkent - növekedése ATP koncentráció, citrát, szabad zsírsavak, NADH.
hexokináz aktivitás csökkenti a koncentráció növekedése a glükóz-6-foszfátot (a csökkenés megfigyelt aktivitást PFK-1).
A tevékenység a piruvát javítja nagy koncentrációjú ADP, AMP; csökkentik az enzim aktivitását - nagy koncentrációban ATP-t, NADH.
Glikolízis is lassú szabályozás által az enzim koncentrációja, hogy végezzük a hormonok, mint az inzulin - stabilizálja bioszintézisét glükokináz PFK-1 és a piruvát-kináz.