szakaszok 5-6
13.Vzaimodeystvie fémek lúgos oldatok.
13.Vzaimodeystvie fémek lúgos oldatok. A vizes oldatok alkálifémek kölcsönhatásba állva az elektrokémiai sorban, hogy a hidrogén és amelyek megfelelnek amfoter oxidok. fémek megfelelő amfoter oxidok: Al, Cr, Zn, Be, Pb, Sn, Sb. 2AL + 2NaOH + 6H2 O = 2Na [Al (OH) 4] + 3H2 ↑
A reakciót alkálifém-megoldásokat.
Fémek, a természetük, nem lép kölcsönhatásba hidrogénatomok a hidroxilcsoport a molekula bázisok. De néhány közülük lúgos oldatok. Lehet reagáltatni alkálifémek, hidroxidok vagy amfoter give rendelkező magas oxidációs fokú jelenlétében erős oxidáló szerekkel. A reakcióban a fémek lúgos oldatok, oxidálószer víz. Példa. Zn + 2NaOH + 2H2 O = Na2 [Zn (OH) 4] + H2 ↑ (122. oldal a helper) 0 1 Zn + 4OH-t - - 2E = [Zn (OH) 4] 2- oxidációja Zn 0 - 1 redukáiószer 2H2 O + 2e = H2 + 2OH - behajtására H2 O - oxidáns Zn + 4OH-t - + 2H2 O = [Zn (OH) 4] 2- + 2OH - + H2 ↑ Fémek, amelyek nagy oxidációs fokú, reakcióba léphetnek lúgok ötvözés: 4NB + 5O2 + 12KOH = 4K3 NbO4 + 6H2 O
14. kiszámítása az elegy összetétele a fémek számának által felszabadított gáz a reakciót egy bázissal vagy savval.
14.Raschet összetétele fémek keveréke a száma által felszabadított gáz a reakciót egy bázissal vagy savval. Tartalom meghatározására (tömeg.%) Cink technikai fél fém minta tömege 800 mg készített oldatát fölös mennyiségű sósavval. Kapacitás (STP) hidrogén fejlődött ml.Vychislit 262 vizsgálati eredmény a minta.
reagáltatásával 1 mol egyenlet 22,4 · l / mol H2 - 1 · 65 g mol / mol Zn
azzal a feltétellel, feladatok 0,262 liter H2 - X d Zn
1. példa Ha a működés során a keverék a réz és 20 g vas és sósav feleslegét visszanyert gáz 5,6 l (STP). Határozza meg a tömegarányai fém a keverékben.
Az első példában, a réz nem reagál a sósavval, azaz hidrogén szabadul során savas reakció a vas. Így, ismerve a hidrogén mennyisége, akkor azonnal megtalálja a száma és súlya a vas. És ennek megfelelően, a tömegarányai a anyag keverékben.
Ilyen megoldásokat 1.
Azt találjuk, a hidrogén: n = V / Vm = 5,6 / 22,4 = 0,25 mól.
Szerint a reakció egyenletet:
A vas mennyisége is 0,25 mól. Megtalálható egy csomó belőle: MFE = 0,25 • 56 = '14
Most lehet számítani tömegarányai a fémek keveréke: ωFe = MFE / mvsey keveréket = 14/20 = 0,7 = 70%
Válasz: 70% vasat, 30% rezet.
A műveletet egy keveréket az alumínium és a vas tömege 11 g sósav feleslegét gázt kiosztott 8,96 liter (STP). Határozza meg a tömegarányai fém a keverékben.
A második példában, mind adja meg a reakció a fém. Voltak hidrogénatom a sav felszabadul mindkét reakcióban. Ezért a közvetlen számítása nem használható. Ilyen esetekben célszerű eldönteni segítségével egy nagyon egyszerű rendszer egyenletek, figyelembe véve a x mólszáma az egyik fém, és a y - mennyisége a második anyag.
2. példa Solution.
Azt találjuk, a hidrogén: n = V / Vm = 8,96 / 22,4 = 0,4 mol.
Tegyük fel, hogy az összeg az alumínium - x mol és vas van mol. Akkor lehet kifejezni x és y, a hidrogén mennyisége:
A móljainak száma hidrogén: NH2 = 3,36 / 22,4 = 0,15 mol, a mólaránya az alumínium hidrogén 2: 3, és ennek következtében, nAl = 0,15 / 1,5 = 0,1 mol. Alumínium Súly: Mal = n • M = 0,1 • 27 = 2,7 g
A maradékot - a vas tömege 3 volt lehetséges, hogy megtalálják a keverék tömegének: msmesi = 16 + 2,7 + 3 = 21,7 g
Tömegtörtje fémek:
A: 73,73 tömeg% rezet, 12,44% alumínium, 13,83% vasat.
Példa 5.21,1 g cink és alumínium elegyében oldjuk 565 ml salétromsavat tartalmazó oldatot 20 tömeg. % HNO3, amelynek a sűrűsége 1.115 g / ml. A kötet a a fejlődő gáz, amely egy egyszerű anyag, és az egyetlen termék a salétromsav helyreállítási volt 2,912 liter (STP). Határozza meg a kapott oldatot összetétele tömeg százalék. (RCTU)
A szövegben ez a probléma egyértelműen meghatározott termék nitrogén hasznosítás - „egyszerű anyag”. Mivel salétromsavat fémekkel megakadályozza hidrogénatom, akkor - a nitrogén. Mindkét fémek oldunk sav. A probléma kérték nem része a kezdeti fémek keveréke, és az összetétele a kapott oldatot a reakció után. Ez teszi a feladat nehezebb.
Az oldatot az 5. példa.
Határozzuk meg az anyag mennyisége a gáz: NN2 = V / Vm = 2,912 / 22,4 = 0,13 mól.
Határozza meg a tömeg salétromsav oldatot, a súly és a mennyisége anyag oldott HNO3:
mrastvora = ρ • V = 1,115 • 565 = 630,3 g mHNO3 = ω • mrastvora = 0,2 • 630,3 = 126,06 g nHNO3 = m / M = 126,06 / 63 = 2 mol
Megjegyezzük, hogy mivel a fém teljesen fel nem oldódik, majd - elég pontosan savat (vízzel, ezek a fémek nem reagálnak). Ennek megfelelően, szükség lesz, hogy ellenőrizze, hogy a sav nem volt feleslegben. és mennyi maradt belőle a reakció után a kapott oldatban.
Felel reakciók (ne felejtsük el, a elektronikus mérleg), és, a kényelem a számítás, átveszi 5x - mennyiségű cink, és több mint 10 éves - az alumínium mennyisége. Aztán, az együtthatóknak megfelelően az egyenletekben, hogy x mol nitrogén-az első reakcióban, és a második - 3Y mol:
A következő kérdés az, hogy marad a Salétromsavoldaioi és mennyi van bízva? A reakció egyenletek, a sav mennyisége reakciójával: nHNO3 = 0,48 + 1,08 = 1,56 mol, vagyis diecetsav meghaladó, és ez lehet kiszámítani kapott maradék: nHNO3 ost. = 2-1,56 = 0,44 mol.
Tehát a végső oldat:
cink-nitrát mennyisége 0,2 mol: MZN (NO3) 2 = n • M = 0,2 • 189 = 37,8 g alumínium-nitrát mennyisége 0,3 mol: Mal (NO3) 3 = n • M = 0, • 3 = 213 63,9 g felesleges salétromsav mennyisége 0,44 mol: mHNO3 ost. = N • M = 0,44 • 63 = 27,72 g
Mi a súlya a végső megoldás? Emlékezzünk, hogy a súlya a végső oldat az alábbi elemekből áll, hogy mi vegyes (oldatok és anyagok), kivéve azokat, a reakciótermékeket, amelyek mentek ki az oldatból (csapadék és gázok):
A súlya az új megoldás
A tömeg szerinti mennyisége a kevert oldatok és / vagy anyagok
Akkor mi a probléma:
mnov. oldat = tömege sav + tömeges fémötvözetből - tömeg nitrogén Mn2 = n • M = 28 • (0,03 + 0,09) = 3,36 g mnov. oldat = 630,3 + 21,1-3,36 = 648,04 g
Most ki lehet számítani a tömeghányada az anyagnak a kapott oldatot:
A: 5,83% cink-nitrát, alumínium-nitrát, 9,86%, 4,28% -os salétromsavat.
6. példa Ha a feldolgozás 17,4 g keveréket a réz, vas és alumínium feleslegét tömény salétromsav kinyerjük gáz 4,48 L (STP), és a kereset a keveréket az azonos tömegű sósav feleslegét - 8,96 liter gázt (STP). Határozzuk meg az összetétele a kiindulási keverékben. (RCTU)
A probléma megoldására azt kell felidézni, hogy először is a tömény salétromsavat egy inaktív fém (réz) ad NO2. és vas és alumínium nem reagálnak rá. Sósav, ellentétben, nem reagál a réz.
Response to 6. példa: 36,8% rezet, 32,2% vasat, 31% alumínium.
Galvánelem - kémiai elektromos áramforrás alapján a kölcsönhatás a két fém, és (vagy) oxidjaik az elektrolitban, ami a megjelenése egy zárt hurok az elektromos áram. Tiszteletére nevezték el Luigi Galvani.


Típusai galvanikus elemek, elemek eltérő elektródák koncentrációja elemek thermogalvanic elemek.
Galvánelem - olyan eszköz, amely a két elektróda leengedjük az elektrolit oldatban, és az elektrolit van csatlakoztatva külső vezeték; létrehozása eszköz EMF eredő elektród áramlási him.reaktsy.
Folyamatai átalakítás elektromos him.energii fordul elő galvánelemek. Az elektród, amelyen oxidáció történik nevezett folyamat-out anód, úgy vélik, a negatív. Az elektróda, amelynél a helyreállítási folyamat következik be az úgynevezett a katód-oldott, úgy tekintjük pozitívnak. Az elektronok kilép a sejt az anód, és mozgassa egy külső áramkör a katód. Vedd szabályok: a bal oldalon az anód, a jobb oldalon - a katód;

2.Protsessy az elektródákon.
Bármilyen intézkedés a sejt folyik rajta egy redox-reakció. A legegyszerűbb esetben, az elektrokémiai cella áll két lemez vagy rúd különböző fémekből és elmerül egy elektrolit oldatban. Egy ilyen rendszer lehetővé teszi, hogy a térbeli szétválasztása a redox reakció „: oxidáció megy végbe a ugyanaz a fém, és a hasznosítás - • a másik. Így, az elektronok átkerülnek a redukálószer, hogy az oxidálószer egy külső körön keresztül.
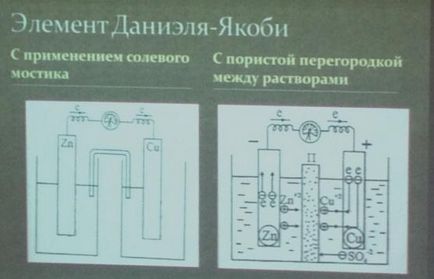
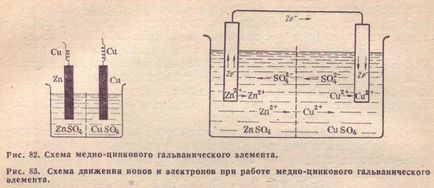
Vegyük, például réz-cink galván cella működési által az energia a fenti reakció a cink és a réz-szulfát (lásd. 82.). Ez az elem (Jacobi elem - Daniel) áll egy rézlemez, merített réz-szulfát-oldatot (réz elektróda), és a cink-lemez, merített cink-szulfát-oldatot (cink elektróda). Mindkét megoldás érintkezésben vannak egymással, hanem, hogy megakadályozzák a keverés révén vannak elválasztva egy partíciót készült porózus anyagból.
.. Amikor a munka elem, azaz, amikor a zárt áramkör, cink oxidálódik: a felületen történő érintkezés egy cink-oldatot atomok válnak ionok és hidratáló, át oldatba. Ahol a felszabaduló elektronok egy külső körön keresztül a réz elektróda. Mindezen folyamatok vázlatosan az alábbi egyenlettel felére reakcióban, vagy elektrokémiai egyenlet:
A réz elektróda áramlik csökkentése a réz ionok. Az elektronok érkező itt a cink elektród köti össze visszavonására az oldatból dehidratált rézionokkal; réz atomok vannak kialakítva, állt ki, mint a fém. A megfelelő elektrokémiai egyenlet:
Az általános egyenlet végbemenő reakció a sejt, akkor kap hozzáadásával az egyenleteket a két fél-reakció. Ennélfogva, működés közben az elektrokémiai cella, elektronokat a redukálószer át az oxidálószer egy külső körön keresztül, az elektródok elektrokémiai folyamatok megfigyelhető az oldat irányított mozgását ionok.
A mozgási iránya az ionok az oldatban miatt elektrokémiai folyamatok előforduló az elektródákon. Mint már említettük, a cinkelektródára kationok oldatba megy, ami benne feleslegben pozitív töltés, míg a réz elektróda oldatot, ezzel szemben, egész idő alatt kimerült kation, úgy, hogy; Itt a megoldás negatív töltésű. Ennek eredményeként, egy elektromos mezőt, ahol a kationok az oldatban (Cu 2+ és Zn 2+), mozgassa a cink elektród a réz, és -SO 2- anionok -TO fordított irányban. Ennek eredményeképpen, a folyadék mind a elektródok elektromosan semleges. Motor mozgását elektronok és ionok a réz-cink-MENT elem ábrán látható. 83.
Az elektród, amelyen az oxidáció végbemegy, úgynevezett n o m e az elektróda, amelyen helyreállítása történik nevezünk egy m d m Egy réz-cink elem a cink elektród az anód, és a réz - .. A katód.
3. A szerepe a porózus fal.
Meg kell mutatni, a szerepe a porózus fal. Ennek célja, csak hogy megakadályozza nem közepes akció réz-szulfát-cink. Közvetlen az intézkedés a réz-szulfát cink reakció energiát akkor szabadítják fel, mint a hőt a elektrokémiai cellában, ahelyett, hogy kapcsolja be az elektromos áram. Egyes konstrukciók, Galve-etnikai elemek porózus blokkolta az FB nem szükséges. Nem lenne szükséges figyelembe véve az elemek Dániel cinket, akkor használjuk volt tökéletesen tiszta; kémiailag tiszta cink, a tapasztalat azt mutatja, nem reagál a réz-szulfát közvetlen érintkezés. A felhalmozott közel a cink felületén a kettős réteg cink pozitív ionok taszítják ugyanolyan töltésű ionok réz és megakadályozza az érintkezést a fémes cinket.
A koncepció a potenciálja.
Ha az alsó fémlemez a vízben, a felület Me ionokat kölcsönhatásba lépnek a poláros vízmolekulák. Polar vízmolekulák támadni kötszerek Th lemez. A -Azok vizes közegben megy végbe, Me ionokat, így a felület a fázisok 2 Me / folyékony formák egy elektromos kétrétegű álló ionok és elektronok Me feleslegben fémlemez. Határán Me / oldat elektromos dupla réteg és a egyensúlyi állapot jön létre.
vagy sem, beleértve a hidratációs víz
Az elektróda potenciálja a fém - egy potenciális különbség a fém-oldat. Ez határozza meg az egyensúlyi állapot az elektróda folyamat. . A nagysága elektród potenciál függ a tulajdonságait a fém, a fémionok koncentrációját az oldatban, és a hőmérséklet. Ez a függőség fejezzük ur-enni Nernst:
Elegendően híg oldatok. Koncentrációja
R = 8,314 J K -1 mol -1 univ.gaz.postoyannaya
F = Cl 96.487 mol -1 Faraday szám
n - a felelős a fémion.
- A standardpotenciál.
Elektróda potenciálokat képest mért normál hidrogén-elektród. A pH-elektród egy lemez készült szivacsos lemez Pt, a leeresztett H2 SO4-oldatot. amelyen keresztül egy hidrogéngáz. Platina utal fémek nagy kémiai ellenállást. A hidrogén-gáz felületén adszorbeált Pt. Növelése az abszorbens kapacitás a fedőréteg a platina szivacs. A platina-felületet, sósavval telített, egyensúly alakul:
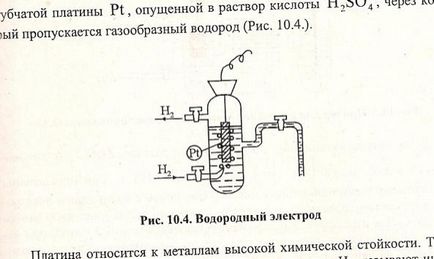
H2 abszolút értéke a hidrogén elektród nem ismert, de a hagyományos úgy vélte, hogy a potenciális standard hidrogén elektród nulla. = 0, amikor = 101325 Pa (760 mm Hg) T = 298 K (25 ° C) [] = 1 mol / l